
【题目】下列溶液中含Cl﹣浓度最小的是( )
A.100mL0.25mol/L的NaCl溶液B.30mL0.1mol/L的KCl溶液
C.20mL0.1mol/L的CaCl2溶液D.10mL0.1mol/L的AlCl3溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列生活生产中常见的物质里含有的有机物属于高分子化合物的是
A. 植物中所含的非常复杂的叶绿素 B. 石油分馏所得的重油中含有的C16H34
C. 植物油水解得到的高级脂肪酸 D. 芹菜中含有的粗糙的纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
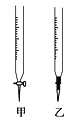

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
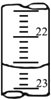
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究__________________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:______、______、滤纸、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) | __ | __ | __ | __ | __ | __ |
①__________________________________________________;
②___________________________________________________;
此实验的结论:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种有机物有如下转化关系。已知B可以发生银镜反应,D气体密度是氢气的14倍。
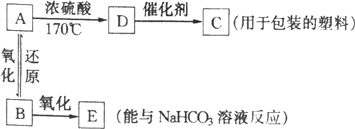
根据图示,
(1)试写出A、C、E的结构简式:A_____、C_______、E________。
(2)写出下列反应的化学方程式:
A→D:_______________________;
A→B: _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
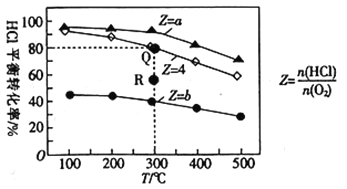
下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明上次考试化学没考好,很沮丧。班主任杜老师开导他说:学习化学一是要有兴趣;二是要做好归纳总结、发现规律,同时还要对特殊情况适当记忆;三是要重视基础,抓住问题的本质。听了老师的话,小明总结了刚学习过的内容,你认为正确的是( )
①由非金属元素组成的化合物一定是共价化合物
②离子化合物一定含离子键,也可能含共价键
③共价键既可能存在于单质和共价化合物中,也可能存在于离子化合物中
④金属性越强的元素相应的简单阳离子氧化性一般越弱
⑤含金属元素的化合物不一定是离子化合物
⑥任何元素的原子都是由核外电子和核内中子、质子组成的
⑦化学反应一定伴随着能量的变化
⑧质子数相同的微粒一定属于同种元素
A. ②③④⑤⑦ B. ②③⑤⑦⑧ C. ①③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为原电池示意图,回答下列问题:
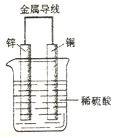
(1)该装置能够将_________能转化成电能。
(2)锌是原电池的_______极,放电过程中____(填“得”或“失”)电子,发生_______反应。
(3)电子是由_______极通过导线流向________极。
(4)铜电极的电极的反应式为____________________
(5)总反应的化学方程式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增加气体反应物浓度,单位体积内活化分子数增加,活化分子百分数增加,有效碰撞次数增加,所以反应速率加快
B. 镁与稀盐酸反应时,加入适量的氯化钾溶液,生成氢气的速率不变
C. 对于可逆反应,升高反应体系温度,正反应速率和逆反应速率均增加
D. 在密闭容器中发生反应 A(g)+B(g)![]() C(g)+D(g),保持恒温恒容,充入气体 He 增大压强,化学反应速率加快
C(g)+D(g),保持恒温恒容,充入气体 He 增大压强,化学反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com