

 .
.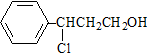 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.分析 (1)①根据甲、乙的结构简式可知,其中含有的碳碳双键、羟基、醛基等都能使高锰酸钾溶液褪色;
②a.苯环上有两个不同的取代基,说明苯环上含有两个取代基且取代基不同;b.能与Br2的CCl4溶液发生加成反应,说明含有碳碳双键;c.遇FeCl3溶液显呈现紫色说明含有酚羟基,据此写出其结构简式;
(2)甲和氯化氢发生加成反应生成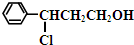 ,
,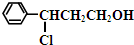 中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:
中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:
(3)能和氢气发生加成反应的有苯环、醛基和碳碳双键,据此确定氢气的物质的量;
(4)乙被新制氢氧化铜氧化生成C6H5CH=CHCOOH,据此写出反应方程式;
解答 解:(1)①根据甲、乙的结构简式可知,其中含有的碳碳双键、羟基、醛基等都能使高锰酸钾溶液褪色,所以不能用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,故答案为:不可行;
②a.苯环上有两个不同的取代基,说明苯环上含有两个取代基且取代基不同;b.能与Br2的CCl4溶液发生加成反应,说明含有碳碳双键;c.遇FeCl3溶液显呈现紫色说明含有酚羟基,则其同分异构体有: 、
、 等,
等,
故答案为: ;
;
(2)甲和氯化氢发生加成反应生成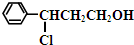 ,
,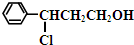 中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:
中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:
故答案为:
(3)能和氢气发生加成反应的有苯环、醛基和碳碳双键,所以1mol乙最多可与 5 mol H2发生加成反应,故答案为:5;
(4)乙与新制Cu(OH)2悬浊液反应的化学方程式为:C6H5CH=CHCHO+2Cu(OH)2$\stackrel{△}{→}$C6H5CH=CHCOOH+Cu2O↓+2H2O,
故答案为:C6H5CH=CHCHO+2Cu(OH)2$\stackrel{△}{→}$C6H5CH=CHCOOH+Cu2O↓+2H2O.
点评 本题考查有机推断,注意能和氢气发生加成反应的不仅有醛基、碳碳双键,还有苯环,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1×10-1mol/L | B. | 1×10-6mol/L | C. | 1×10-3mol/L | D. | 1×10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 盐酸、水玻璃、氨水均为混合物 | D. | 烧碱、冰醋酸、四氯化碳均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| B. | 用酸性KMnO4溶液除去乙烷中混有的乙烯 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
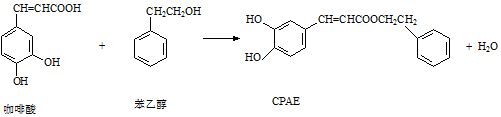
| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含3 mol NaOH的溶液发生反应 | |
| C. | 不能用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=△H1+2△H2 x=xy2 | B. | H3=△H1+△H2 z=x+y | ||
| C. | H3=△H1+2△H2 x=x-y2 | D. | H3=△H1+△H2 z=$\frac{x}{y}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
| ① | 25℃ | 10.0 | 0 | 10.0 | |
| ② | 25℃ | 5.0 | a | 10.0 | |
| ③ | 45℃ | 10.0 | 0 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com