
| A. | 次氯酸的电子式  | B. | 钠离子的结构示意图 | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 二氧化硅的分子式 SiO2 |
分析 A.次氯酸的中心原子是氧原子;
B.钠离子核外有10个电子;
C.硫原子最外层有6个电子,在3s能级上有两个电子,在3p能级上有4个电子;
D.二氧化硅为原子晶体,不存在二氧化硅分子.
解答 解:A.次氯酸中氧元素是-2价,氯元素是+1价,次氯酸的中心原子是氧原子,正确应为: ,故A错误;
,故A错误;
B.钠离子核外有10个电子,其离子结构示意图为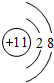 ,故B错误;
,故B错误;
C.硫原子最外层有6个电子,在3s能级上有两个电子,在3p能级上有4个电子,所以其最外层电子排布式3s23p4,故C正确;
D.二氧化硅晶体为原子晶体,不存在SiO2分子,故D错误;
故选C.
点评 本题主要考查了化学用语的表示方法,题目难度中等,明确常见化学用语的书写原则为解答关键,易错选项是D,二氧化硅为原子晶体,还要注意次氯酸的中心原子是哪种元素,为易错点.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 强酸与强碱反应都是放热反应 | |
| B. | 氧化还原反应一定都是放热反应 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Na2CO3溶液中含碳元素微粒有多种,常温下,这些微粒的物质的量分数与溶液pH的变化关系如图所示.下列说法正确的是( )
Na2CO3溶液中含碳元素微粒有多种,常温下,这些微粒的物质的量分数与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐渐滴加盐酸至溶液恰好变为无色,得到NaHCO3溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 实验序号 | 实验操作 | 实验现象 |
| 步骤 I | 分别取等体积、等物质的量浓度的碳酸钠和碳酸氢铵溶液,滴加酚酞试液 | 两份溶液均变为红色 |
| 步骤 II | 加热两份溶液 | 溶液颜色均变深 |
| 步骤 III | 将上述两份溶液恢复到室温 | 碳酸钠溶液颜色恢复为原来的深浅;碳酸氢钠溶液的颜色也变浅,但比原先要深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 | |
| B. | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性 | |
| C. | H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 | |
| D. | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含CCl4分子数为NA | |
| B. | 4.0gNaOH固体溶于100 mL水中,得到1 mol/L的NaOH溶液 | |
| C. | 常温常压,5.6gFe在足量Cl2中燃烧,转移的电子数为0.3NA | |
| D. | 分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | ① | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com