

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
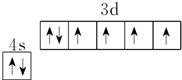 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
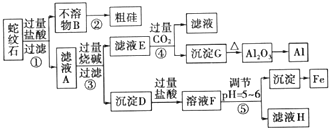
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 成语、谚语、俗语 | 理解或寓意 |
| A | “甘之如饴” | 糖类均有甜味 |
| B | “冰、水为之,而寒于水” | 相同质量和温度的水和冰,冰的能量高 |
| C | “雷雨肥庄稼” | 农作物生长需要水,雷雨天提供了大量的雨水 |
| D | “春蚕到死丝方尽” | 蚕丝的只要成分是蛋白质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与元素Y能形成离子化合物 | |
| B. | 原子序数为:X<Y<Z | |
| C. | 元素Z最高价氧化物对应水化物具有两性 | |
| D. | 元素Y形成的气态氢化物水溶液呈强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.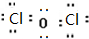 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com