
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
分析 (1)根据各物质的溶度积常数计算出开始沉淀时溶液中氢氧根离子的浓度,再判断;
(2)实验室用加热氯化铵和氢氧化钙固体混合物来制备氨气;原电池中N2H4失电子,在负极上反应;
(3)①破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则该反应为放热反应,根据温度对平衡的影响分析;
②根据生成的氨气的量求出氢气的浓度变化量,再求反应速率;N2的转化率α(N2)=$\frac{n(转化的氮气的量)}{n(氮气的初始量)}$×100%;根据影响K的因素分析;
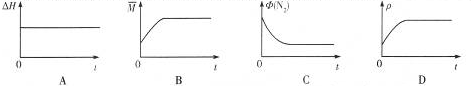
③反应达到平衡状态时,同一物质的正逆反应速率相等,平衡时各种物质的物质的量浓度、百分含量等不再发生变化,以及由此衍生的一些量也不发生变化,说明可逆反应到达平衡状态,结合图象分析.
解答 解:(1)向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol•L-1的溶液中缓慢滴加稀氨水,
开始生成Cu(OH)2沉淀时,c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$=$\sqrt{\frac{2.2×1{0}^{-20}}{0.01}}$=$\sqrt{2.2}$×10-9mol•L-1,
开始生成Fe(OH)3沉淀时,c(OH-)=$\root{3}{\frac{4.0{×}^{-38}}{0.01}}$=$\root{3}{4}$×10-12mol•L-1,
开始生成Fe(OH)2沉淀时,c(OH-)=$\sqrt{\frac{8×1{0}^{-16}}{0.01}}$=$\sqrt{8}$×10-7mol•L-1,
开始生成Mg(OH)2沉淀时,c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{0.01}}$=$\sqrt{18}$×10-5mol•L-1,
开始生成沉淀时溶液中氢氧根离子浓度越小,则该物质越容易沉淀,所以产生沉淀的先后顺序为Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2;
故答案为:Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2;
(2)实验室用加热氯化铵和氢氧化钙固体混合物来制备氨气,氯化铵和氢氧化钙反应生成氨气、氯化钙和水,其反应的方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;原电池中NH3失电子,在负极上反应生成N2H4,其负极的电极反应式为:2NH3+2OH--2e-═N2H4+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;2NH3+2OH--2e-═N2H4+2H2O;
(3)①破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则该反应为放热反应,升高温度平衡逆向移动,氨气的物质的量减小,已知T1时氨气的物质的量大,说明T1时温度低,则T1<T2;
故答案为:<;
②在T2K下,经过10min达到化学平衡状态,平衡时氨气的物质的量为2mol,则反应的氢气为2mol×$\frac{3}{2}$=3mol,v=$\frac{\frac{△n}{V}}{t}$=$\frac{\frac{3mol}{3L}}{10min}$=0.1 mol•L-1•min-1;N2的转化率α(N2)=$\frac{n(转化的氮气的量)}{n(氮气的初始量)}$×100%=$\frac{2mol×\frac{1}{2}}{4mol}$×100%=25%;该反应的平衡常数只与温度有关,再增加氢气浓度,反应的平衡常数将不变;
故答案为:0.1 mol•L-1•min-1; 25%;不变;
③A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B.随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C.随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D.容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
故答案为:BC.
点评 本题考查了溶度积常数的应用、原电池原理、化学平衡状态的判断、反应速率的计算等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等,注意把握溶度积的含义和公式应用、电极方程式的书写、化学平衡的有关计算.


科目:高中化学 来源: 题型:解答题
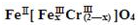 (铁氧磁体,罗马数字表示元素价态)的沉淀.
(铁氧磁体,罗马数字表示元素价态)的沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| B. | Ksp只与难溶电解质的性质和温度有关 | |
| C. | 其他条件不变,离子浓度改变时,Ksp不变 | |
| D. | 两种难溶电解质,Ksp小的,溶解度一定小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX<HY<HZ | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性X->Y->Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用乙醇汽油作汽车燃料 | |
| B. | 研制开发以水代替有机溶剂的化工涂料 | |
| C. | 农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源 | |
| D. | 包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊溶液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3,有白色沉淀生成,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 3.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com