
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含![]() 等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
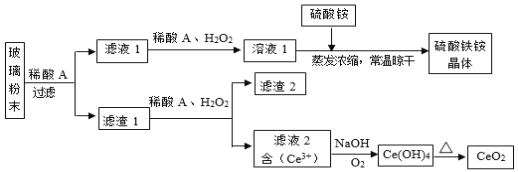
(1)稀酸A的分子式是___________。
(2)滤液1中加入H2O2溶液的目的是___________。
(3)设计实验证明滤液1中含有Fe2+____________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式________________。
(5)由滤液2生成![]() 的离子方程式______________。
的离子方程式______________。
(6)硫酸铁铵晶体![]() 广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是_________。
广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是_________。
(7)取上述流程中得到的![]() 产品0.832g,加硫酸溶解后,用浓度为0.1000
产品0.832g,加硫酸溶解后,用浓度为0.1000![]() 的
的![]() 标准溶液滴定至终点时(铈被还原为
标准溶液滴定至终点时(铈被还原为![]() ),消耗20.00mL标准溶液。该产品中
),消耗20.00mL标准溶液。该产品中![]() 的质量分数为___________。
的质量分数为___________。
【答案】![]() 使
使![]() 氧化为
氧化为![]() 取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有
取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有![]() Fe2++2FeO(OH)=Fe3O4+2H+ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓ Fe3++3H2OFe(OH)3+3H+,酸性废水抑制
Fe2++2FeO(OH)=Fe3O4+2H+ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓ Fe3++3H2OFe(OH)3+3H+,酸性废水抑制![]() 的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 50%
的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 50%
【解析】
![]() 中
中![]() 不溶于硫酸,滤渣1是
不溶于硫酸,滤渣1是![]() ,滤渣1加入还原剂H2O2,CeO2被还原为Ce3+,Ce3+与NaOH、O2反应生成Ce(OH)4,Ce(OH)4受热分解成CeO2;
,滤渣1加入还原剂H2O2,CeO2被还原为Ce3+,Ce3+与NaOH、O2反应生成Ce(OH)4,Ce(OH)4受热分解成CeO2;![]() 溶于硫酸生成硫酸铁、硫酸亚铁,滤液1含有硫酸铁、硫酸亚铁,加入H2O2,硫酸亚铁被氧化为硫酸铁,硫酸铁溶液中加入硫酸铵,蒸发浓缩、常温晾干获得硫酸铁铵晶体。
溶于硫酸生成硫酸铁、硫酸亚铁,滤液1含有硫酸铁、硫酸亚铁,加入H2O2,硫酸亚铁被氧化为硫酸铁,硫酸铁溶液中加入硫酸铵,蒸发浓缩、常温晾干获得硫酸铁铵晶体。
(1) CeO2不溶于稀硫酸,产品有硫酸铁铵,所以稀酸A是硫酸,分子式是![]() ;
;
(2) 滤液1含有硫酸铁、硫酸亚铁,加入H2O2,硫酸亚铁被氧化为硫酸铁,滤液1中加入H2O2溶液的目的是使![]() 氧化为
氧化为![]() ;
;
(3) 滤液1含有硫酸铁、硫酸亚铁,亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,故取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有![]() ;
;
(4) Fe3O4中Fe2+、Fe3+的比为1:2,酸性、含有Fe2+溶液和难溶于水的FeO(OH)反应生成Fe3O4的离子方程式是Fe2++2FeO(OH)=Fe3O4+2H+;
(5)滤液2中Ce3+在氢氧化钠溶液中被氧气氧化为![]() ,反应的离子方程式4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓;
,反应的离子方程式4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓;
(6) 硫酸铁铵净水的原理是Fe3++3H2OFe(OH)3+3H+,酸性废水抑制![]() 的水解,使其不能生成有吸附作用的Fe(OH)3胶体,故在去除酸性废水中的悬浮物时效率降低;
的水解,使其不能生成有吸附作用的Fe(OH)3胶体,故在去除酸性废水中的悬浮物时效率降低;
(7) ![]() 加硫酸溶解后生成的Ce4+被
加硫酸溶解后生成的Ce4+被![]() 还原为
还原为![]() ,根据得失电子守恒,反应关系式是
,根据得失电子守恒,反应关系式是![]() ~Ce4+~
~Ce4+~![]() ,0.832g产品中含
,0.832g产品中含![]() 的物质的量是0.02L×0.1
的物质的量是0.02L×0.1![]() =0.002mol,该产品中
=0.002mol,该产品中![]() 的质量分数为
的质量分数为![]() =50%。
=50%。


科目:高中化学 来源: 题型:
【题目】下列关于离子检验的说法中正确的是( )
A.向某溶液中加稀盐酸,将产生的无色无味气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定含有大量CO![]()
B.向某溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀产生,则原溶液中一定有SO![]()
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液呈碱性
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀硝酸,沉淀不消失,则原溶液中一定有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3.H2O的电离常数均为1.8×10-5mol/L。向20mL浓度均为0.1mol/LNaOH和NH3.H2O的混合液中滴加等浓度的CH3COOH溶液,所得混合液的相对导电能力与加入CH3COOH溶液的体积(V)关系如图所示。下列说法正确的是( )
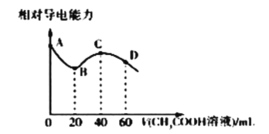
A.由A点溶液到B点溶液相对导电能力降低主要是因为离子的总物质的量减少
B.A、B、C、D四点溶液中B点溶液中水的电离程度最大
C.C点溶液呈碱性
D.D点溶液中存在: c(Na+)>c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
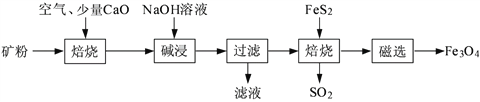
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
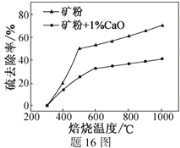
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药物“6-Azulenol”的结构简式如图所示,下列有关它的叙述不正确的是
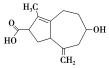
A.分子式为C13H18O3
B.能发生酯化反应、取代反应、还原反应、中和反应、消去反应
C.能使酸性高锰酸钾溶液褪色
D.1 mol该物质最多可以与3 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种盐的溶解度曲线,下列说法正确的是( )
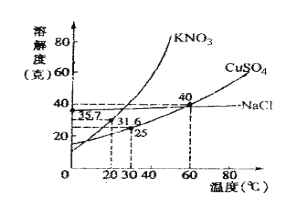
A. 40℃时,将35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体
B. 20℃时,硝酸钾饱和溶液的质量分数是31.6%
C. 60℃时,200g水中溶解80g硫酸铜达饱和。当降温至30℃时,可析出30g硫酸铜晶体
D. 30℃时,将35g硝酸钾和35g 食盐同时溶于100g水中,溶液蒸发时,先析出的是氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或分子结构模型表示正确的是
A.中子数为146、质子数为92的铀(U)原子![]()
B.四氯甲烷的球棍模型:![]()
C.乙烷的结构简式:CH3CH3
D.HClO的电子式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com