
| A. | ②⑤ | B. | ④⑤ | C. | ②③ | D. | ⑤ |
分析 ①钠是银白色金属,具有金属通性;质软,可以用小刀切割,密度比水小,能浮在水面上;熔点低于100℃;
②钠很活泼,极易和空气中氧气、水蒸气反应;
③钠密度大于煤油其和煤油不反应,钠极易和氧气、水反应;
④钠的焰色反应呈黄色,且燃烧生成过氧化钠;
⑤钠表面不能形成致密氧化膜,长期置于空气中,最后变为碳酸钠.
解答 解:①钠是银白色金属,具有金属光泽,具有金属通性,是热和电的良导体;质软,可以用小刀切割,密度比水小,能浮在水面上;熔点低于100℃,故正确;
②钠很活泼,极易和空气中氧气、水蒸气反应,所以钠在自然界中以化合态形式存在,故正确;
③钠密度大于煤油其和煤油不反应,钠极易和氧气、水反应,所以金属钠可以保存在煤油中以隔绝空气和水,钠着火时可用沙子盖灭,故正确;
④钠的焰色反应呈黄色,且燃烧生成淡黄色固体过氧化钠,故正确;
⑤钠表面不能形成致密氧化膜,长期置于空气中,先生成氧化钠,氧化钠和水反应生成NaOH,NaOH和二氧化碳反应生成碳酸钠,故错误;
故选D.
点评 本题考查钠的性质,为高频考点,明确钠原子结构与性质、性质与贮存关系是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在恒温恒容 密闭容器中,能说明反应:2N02(g)
密闭容器中,能说明反应:2N02(g) 2NO(g)+02(g)达到平衡
2NO(g)+02(g)达到平衡 状态的是 ( )
状态的是 ( )
①单位时间内生成nmol O2的同时生成2nmol NO2;②单位时间内生成nmol O2的同时生成2nmol N0;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态。
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
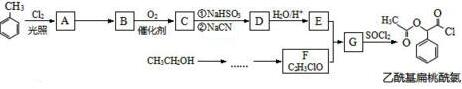
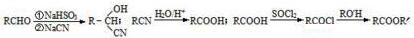
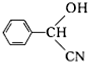 .
.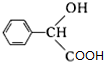 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300KJ/mol 当有5NA个电子转移时能放出650KJ的热量 | |
| B. | 有28g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 有反应H2(g)+I2(g)?2HI(g)△H=-QHJ/mol在298K 101KPa下向一密闭容器中充入NA个H2和NA个I2,充分反应共放出热量为QKJ | |
| D. | 在78g苯中含3NA个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K${\;}_{\;}^{35}$ClO3+6H${\;}_{\;}^{37}$Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为$\frac{5}{3}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲<乙,简单阴离子的半径:丙>丁>戊 | |
| B. | 非金属性:乙<丁 | |
| C. | 最高价氧化物对应的水化物的酸性:丙<丁 | |
| D. | 气态氢化物的稳定性:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA水溶液中微粒浓度大小顺序:c(HA)>c(H+)>c(A-)>c(OH-) | |
| B. | NaA水溶液中:c(Na+)═c(A-)+c(HA) | |
| C. | HA与NH3作用生成的化合物是共价化合物 | |
| D. | 稀释0.1mol/LHA水溶液,其电离程度增大,pH也增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com