
����Ŀ������۲�����װ�ã��ش��������⣺

(1)װ��B��PbO2�Ϸ����ĵ缫��Ӧ����ʽΪ___��������K+����___(����װ��B������װ��C��)��
(2)װ��A���ܷ�Ӧ�����ӷ���ʽΪ___��
(3)��װ��E�е�Ŀ������Cu�����϶�������XΪ___������N�IJ���Ϊ___��
(4)װ��D���Ҳ�ʯī�缫��ӦʽΪ��___��
(5)ij������������Һʵ�ַ��硢������λһ���ϵ�װ��ʾ��ͼ��ͼ��ʾ������װ�ù���ʱ����Ҫ����գ�
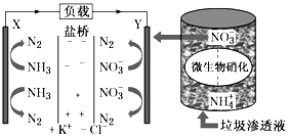
�ٵ����ɼ�___(����X��Y������Y��X��)������·������7.5mol����ʱ����������״����N2�����Ϊ___��
��Y�������ķ�ӦΪ��___��
���𰸡�PbO2+2e-+4H++SO42- =PbSO4+2H2O װ��B Cu+2H+![]() Cu2++H2�� AgNO3 Ag 2Cl--2e-=Cl2�� Y��X 44.8L 2NO
Cu2++H2�� AgNO3 Ag 2Cl--2e-=Cl2�� Y��X 44.8L 2NO![]() +10e-+6H2O=N2��+12OH-
+10e-+6H2O=N2��+12OH-
��������
��ͼʾ��֪��B��C���������ӣ����B��Cװ���е������Һ�͵缫��B��C����Ǧ���أ�����ԭ���װ�ã�Ǧ��������ΪPbO2������ΪPb����A��D��EΪ���أ����ص�������ԭ��ص����������������븺����������װ��A�У�Pt�缫Ϊ������Cu�缫Ϊ������װ��D�У���˵�ʯī�缫Ϊ�������Ҷ˵�ʯī�缫Ϊ������װ��E��M�缫Ϊ������N�缫Ϊ�������ݴ˷������(1)~(4)��
(5)���ݴ�����������Һ�����䷢���ʾ��ͼ֪����װ������ԭ���װ�ã�X�Ǹ�������������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��2NH3-6e-+6OH-�TN2+6H2O��Y��������NO3-�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��2NO3-+10e-+6H2O�TN2��+12OH-�������������������������������������������������������ݴ˻ش�
(1)���ݷ�����B��C����Ǧ���أ�����ԭ���װ�ã�Ǧ��������ΪPbO2���缫��Ӧ����ʽΪPbO2+2e-+4H++SO42-=PbSO4+2H2O��ԭ������������������ƶ�����������K+����PbO2�缫���ڵ�װ���ƶ�����װ��B�ƶ���
(2)���ݷ�����װ��AΪ���أ�װ��A�У�Cu�缫Ϊ�������缫��ӦΪ��Cu-2e-=Cu2+��Pt�缫Ϊ���������ݷŵ�˳���������������ŵ磬�缫��ӦΪ��2H++2e-=H2������װ��A���ܷ�Ӧ�����ӷ���ʽΪCu+2H+![]() Cu2++H2����
Cu2++H2����
(3)���ݷ�����װ��EΪ���أ�����M�缫Ϊ������N�缫Ϊ��������װ��E�е�Ŀ������Cu�����϶���������Ϊ�Ʋ������CuΪ�Ƽ�����Ƴ��жƲ�������������Ƽ������������ҺҪ���жƲ�������ӣ���XΪAgNO3������N�IJ���ΪAg��
(4)���ݷ�����װ��DΪ���أ������Ҷ˵�ʯī�缫Ϊ�������������ҺΪ�Ȼ�����Һ�������������ӷŵ磬���ݷŵ�˳���������������Ϸŵ磬�缫��ӦʽΪ��2Cl--2e-=Cl2����
(5)�ٸ��ݷ�����֪��װ������ԭ���װ�ã�X�Ǹ�����Y��������������������������������Y��X��X�Ǹ�������������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��2NH36e+6OH�TN2+6H2O��Y��������NO3�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��2NO3+10e+6H2O�TN2��+12OH�����ܷ�ӦʽΪ��5NH3+3NO3�T4N2+6H2O+3OH�����ݵ���ܷ�Ӧ��֪������4mol N2ʱ��·��ת��15mol���ӣ���·������7.5mol����ʱ����������״����N2�����Ϊ![]() ��4mol��22.4L/mol=44.8L��
��4mol��22.4L/mol=44.8L��
�ڸ��ݷ�����Y��������NO3-�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��2NO3-+10e-+6H2O�TN2��+12OH-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��H2CO3��Ka1=4.2��10-7��Ka2=5.6��10-11����������10mL0.1mol/LNa2CO3��Һ����μ���0.1mol/LHCl��Һ����ͼ����Һ�к�̼Ԫ�������ʵ���������pH���Ͷ��仯��ͼ��(CO2�����ݳ�δ����).����˵��������ǣ� ��

A.A����ʾ��Һ��c(H+)=5.6��10-11
B.B����ʾ��Һ��c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.05mol/L
C.A���B�㷢����Ӧ�����ӷ���ʽΪCO32-+H+=HCO3-
D.�ֲ������̪�ͼ��ȣ��õζ����ɲⶨNa2CO3��NaHCO3���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.�ڶ��ױ�ֻ��һ�ֽṹ����֤�������в�����̼̼������̼̼˫������Ľṹ
B.�߾���![]() �ĵ������ͨ����ϩ��HCl�ӳ��Ƶ�
�ĵ������ͨ����ϩ��HCl�ӳ��Ƶ�
C.��CH3��2CH��CH=CH��C��CH3��3�������ӳɺ�IJ�����ϵͳ����������Ϊ2��2��5����������
D.��ȫȼ��һ�������ı����ᡢ�����ǻ��������������Ȼ�ϣ�������CO2��H2O�����ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2017������)��ѹ���ʻ�������������ԭ��Ϊ��Ni(s)+4CO(g)![]() Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
��һ�Σ���������CO��Ӧת������̬Ni(CO)4��
�ڶ��Σ�����һ�η�Ӧ���������������������230���Ƶøߴ�����
�����ж���ȷ����
A. ����c(CO)��ƽ���������ƶ�����Ӧ��ƽ�ⳣ������
B. �ڶ��Σ�Ni(CO)4�ֽ��ʽϵ�
C. ��һ�Σ���30����50������֮��ѡ��Ӧ�¶ȣ�ѡ50��
D. �÷�Ӧ�ﵽƽ��ʱ��v����[Ni(CO)4]=4v����(CO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25 ��ʱ��CaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����100 mL�������µ�CaSO4������Һ�м���400 mL 0.01 mol��L��1Na2SO4��Һ,����������ȷ����
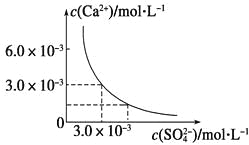
A.��Һ������CaSO4���������������Һ��c(SO42-)��ԭ���Ĵ�
B.��Һ��������������Һ��c(Ca2��)��c(SO42-)����С
C.��Һ������CaSO4�����������Һ��c(Ca2��)��c(SO42-)����С
D.��Һ��������������������Һ��c(SO42-)��ԭ���Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���ӿ���ҩ��ķ��ӽṹ����ͼ��ʾ������˵����ȷ���ǣ� ��

A.1mol���л��������Ժ�5mol NaOH��Ӧ
B.���л����������ӳɡ�ȡ�����к͡���ȥ�ȷ�Ӧ
C.���л�����FeCl3��Һ����ɫ������ʹ����KMnO4��Һ��ɫ
D.1mol���л�����Ũ��ˮ��������Ӧ���������3mol Br2��6molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.Ǧ���صĹ���ԭ��Ϊ��Pb+PbO2+2H2SO4=2PbSO4+2H2O��Ǧ�����ڷŵ�����У������������ӣ���������Ҳ����
B.��������ұ������Ϊ��
C.������Ũ�������ۻ����ɱ����ڲ�������ʴ�������ȷ�Ӧ����
D.һ�������£�ʹ�ô����ܼӿ췴Ӧ���ʵ�����߷�Ӧ���ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������������Ӧ2A(g)+B(g)![]() 2C(g)��������������˵���÷�Ӧ�ﵽƽ�����
2C(g)��������������˵���÷�Ӧ�ﵽƽ�����
A.2����(B)������(C)
B.����ϵ���ܶȲ���ʱ����仯
C.����ϵ���¶Ȳ���ʱ����仯
D.1molA�Ļ�ѧ�����ѣ�ͬʱ1molC�Ļ�ѧ��Ҳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH4��g��+2O2��g��=CO2��g��+2H2O��l�� ��H1=��Q1kJmol��1
2H2��g��+O2��g��=2H2O��g����H=��Q2kJmol��1��
2H2��g��+O2��g��=2H2O��l�� ��H2=��Q3kJmol��1
�����£�ȡ�����2��3�ļ���������Ļ������11.2 L����״���£�������ȫȼ�պ�ָ������£���ų�������Ϊ��������
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com