
【题目】已知反应:CH3CHO(g)+aO2(g)=X+bH2O(l) ΔH ,X为下列何种物质时ΔH最小( )
A.CH3COOH(l)
B.CH3COOH(g)
C.CO(g)
D.CO2(g)
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在一个体积为1 L的密闭容器中发生某化学反应:2A(g) ![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
(1)在实验Ⅰ中,反应在2040 min内A的平均反应速率为mol L-1min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是。
(2)该反应的ΔH0,其判断理由是。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L1
B.0.4 mol·L1
C.0.7 mol·L1
D.0.8 mol·L1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应____________。
A.等于86%
B.等于50%
C.小于50%
D.在50%86%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为___,负极反应式为____________________;正极材料为_____,正极反应式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯在一定条件下能发生下列转化:
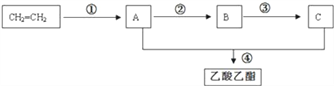
请根据上图回答:
(1)反应①、②的反应类型依次是_________、_________;
(2)物质A、C中所含官能团的名称依次是_______、_______;
(3)分别写出②、④反应的化学方程式(有机物用结构简式表示):______________________________、_____________________________。
(4)乙烯在一定条件下能发生聚合反应得到高分子化合物,所得产物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇(PPG)是一种可降解的聚脂类高分子材料,在材料的生物相容性方面有限好的应用前景.PPG的一种合成路线如下: 
已知;
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8
③E、F为相对分子质量差14的同系物,F是福尔马琳的溶质
④R1CHO+R2CH2CHO ![]()
![]()
回答下列问题:
(1)A的结构简式为 .
(2)由B生成C的化学方程式为 .
(3)由E和F生成G的反应类型为 , E的化学名称为 .
(4)由D和H生成PPG的化学方程式为;
(5)D的同分异构体能同时满足下列条件的共有种(不含立体异构); ①能与饱和NaHCO3溶液反应产生液体
②既能发生银镜反应,又能发生水解反应,其中核磁共振请谱显示为3组峰,且峰面积比为6:1:1的是有(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语描述中不正确的是( )
A. 中子数为20的氯原子:![]()
B. K2O的电子式:![]()
C. HCO3﹣的电离方程式:HCO3﹣+H2O![]() CO32﹣+H3O+
CO32﹣+H3O+
D. 比例模型![]() 可以表示CO2分子或SiO2
可以表示CO2分子或SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物的用途广泛。锑与砷同族,以辉锑矿为原料制备金属锑,其中一种工艺流程如图甲所示:

已知部分信息如下:
Ⅰ.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
Ⅲ.常温下,Ksp(CuS)=10×10-36、Ksp(PbS)=9.0×10-29
Ⅳ.H3PO2是一元中强酸。
回答下列问题:
(1)锑在周期表中的位置是___________,NaH2PO2的名称为________________。
(2)“酸浸”过程中SbCl5和Sb2S3反应有S生成,滤渣1的主要成分是__________(填化学式)。
(3)写出“还原”过程中反应的化学方程式:_____________________。
(4)已知浸出液中:c(Cu2+)=0.01mol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是________________(填化学式);加入硫化钠的量不宜过多,原因是__________________ 。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应中还原剂、氧化剂的物质的量之比为______。
(6)“电解”中锑的产率与电压大小关系如图乙所示。当电压超过U0V时,锑的产率降低的原因可能是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Y原子的最外层电子数是内层电子数的2倍,Z、W在元素周期表中处于同周期相邻的位置,它们的单质在常温下均为无色气体。试回答:
(1)写出下列元素的元素符号: X ________ ,Y ________ ,Z _________,W__________
(2)X的单质和Z的单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件)________________________ 。
(3)这四种元素可组成原子个数比为5:1:1:3(按X、Y、Z、W的顺序)的化合物化学式为_____________ ,含有化学键有 _________、_____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com