
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸(H2C2O4)的反应,记录如表所示的实验数据:
实验 | 实验 | 试管中所加试剂及其用量/mL | 溶液褪至无 | |||
编号 | 温度 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | 色所需时间 /min |
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式 ______,当该反应以表中数据反应完全时转移电子数为NA。
(2)V1=_______mL。
(3)根据表中的实验①、②数据,可以得到的结论是 _______。
(4)探究温度对化学反应速率的影响,应选择 _______(填实验编号)
实验编号 | 实温度 /℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间/min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
(5)该小组根据经验绘制了 n (Mn 2+)随时间变化的趋势如图 1 所示,但有同学查阅已有实验资料发现,该实验过程中 n (Mn 2+)随时间变化的实际趋势如图 2 所示。
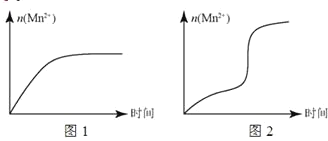
该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
②小组同学提出的假设是________。
②若该小组同学提出的假设成立,应观察到________现象。
【答案】2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 0.00075 2.0 ② ③ 褪色时间变短
【解析】
(1)发生氧化还原反应,Mn元素的化合价降低,C元素的化合价升高,结合化合价变化计算转移电子;
(2)由控制变量法可知,总体积相同;
(3)实验①、②数据中只有浓度不同;
(4)②③中只有温度不同;
(5)由图可知生成锰离子可作催化剂加快反应速率。
(1)该反应的离子方程式为 2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O, n(KMnO4)=0.05mol/L×0.003L=1.5×10﹣4mol,n(H2C2O4)=0.6mol/L×0.003L=1.8×10-3mol,高锰酸钾反应完全时转移电子数为 1.5×10﹣ 4mol×(7﹣2)×NA= 0.00075NA,故答案为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;0.00075;
(2)由控制变量法可知,总体积相同,则 V1=10.0﹣8.0=2.0, 故答案为:2.0;
(3)实验①、②数据,可以得到的结论是其他条件相同时,反应物浓度减小,反应速率减慢,故答案为:其他条件相同时,反应物浓度减小,反应速率减慢;
(4)探究温度对化学反应速率的影响,应选择②、③, 故答案为:②;③;
(5)①由图可知提出的假设是 Mn2+对该反应有催化作用, 故答案为:Mn2+对该反应有催化作用;
②提出的假设成立,应观察到褪色时间变短现象, 故答案为:褪色时间变短。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:

(1)该反应的化学方程式是_________。若t1=10min,用X表示化学反应速率为_________
(2)若上述反应中X,Y,Z分别为NH3、H2、N2, 且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;
(3)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”或“不变”)。化学平衡常数K_______ (填“增大”或“减小”或“不变”)
(4)在一定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________
②能判断该反应达到化学平衡状态的依据是_______
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__________℃;
(6)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L-1,c(H2)=1.5mol·L-1,c(CO)=1mol·L-1,c(H2O)=3mol·L-1,则下一时刻,反应向__________(填"正反应"或"逆反应")方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molCO和3molH2O混合于2L的密闭容器中,发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
(1)该化学反应的平衡常数表达式:___。
(2)已知在700℃时,该反应的平衡常数K1=2,则该温度下反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K2=__,反应2CO(g)+2H2O(g)2CO2(g)+2H2(g)的平衡常数K3=___。
(3)已知在1000℃时,该反应的平衡常数K4=1.0,则该反应为___反应(填“吸热”或“放热”),△H__0(填“>”或“<”)。
(4)在1000℃下,某时刻CO2的物质的量为1mol,则此时υ(正)__υ(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100mol/LHCl溶液滴定0.100mol/LNa2CO3溶液的滴定曲线如图,已知f=![]() 。下列说法错误的是
。下列说法错误的是

A.a点溶液中:c(HCO3-)>c(CO32-)
B.b点溶液中:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.溶液中水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴加到HA溶液中,测得混合溶液的pH与p![]() 转化关系如图所示[已知:p
转化关系如图所示[已知:p![]() =-lg
=-lg![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A.m点:c(A-)=c(HA)
B.Ka(HA)的数量级为10-6
C.水的电离程度:m<r
D.r点:c(H+)+c(Na+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。

查阅资料:
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O
③已知Al4C3与CaC2类似易水解,CaC2的水解方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑
(1)装置A中反应的化学方程式为___。
(2)装置F的作用为___;装置B的名称为___。
(3)按气流方向各装置从左到右的连接顺序为A→__。(填装置名称对应字母,每个装置限用一次)
(4)实验中若将A中分液漏斗换成![]() (恒压漏斗)更好,其原因是___。
(恒压漏斗)更好,其原因是___。
(5)装置D中可能观察到的现象是___。
(6)当反应结束后,装置D处试管中固体全部变为红色。设计实验证明红色固体中含有Cu2O(简述操作过程及现象):__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:

下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杯环芳烃因其结构类似于酒杯而得名,其键线式如图,下列关于杯环芳烃的说法正确的是( )
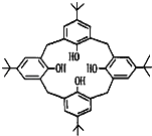
A.属于芳香烃B.最多与6mol H2发生加成反应
C.分子式为C44H56O4D.分子内所有原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液,只可能含有下表中的若干种离子:
可能大量含有的阳离子 |
|
可能大量含有的阴离子 |
|
当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是![]()
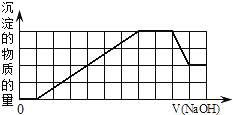
A.原溶液中加入盐酸有沉淀生成
B.原溶液中一定含有![]() 和
和![]()
C.反应最后得到的沉淀只有![]()
D.反应最后形成的溶液中溶质只有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com