
| A、I- |
| B、HCO3- |
| C、Fe2+ |
| D、NO3- |


科目:高中化学 来源: 题型:
| A、CH3-CH2-NO2和N2H-CH2-COOH互为同分异构体 |
| B、O2和O3互为同素异形体 |
| C、CH3CH3和CH3CH3CH互为同系物 |
| D、干冰和冰为同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 6 |
| 顺序 | 步骤 | 实验现象 |
| 1 | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| 2 | 滴入淀粉KI溶液,振荡 | 溶液无变化 |
| 3 | 然后再滴加稀H2SO4,振荡. | 溶液变蓝色 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
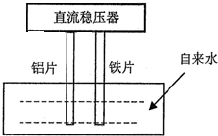 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
B、三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体Fe3++3H2O
| ||||
C、碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-
| ||||
| D、铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3?H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
| C、0.1 mol?L HA(一元酸)溶液与0.1mol?L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(A-) |
| D、常温下0.4 mol/L HA溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com