
| A. | CH3COOH的电离程度变大 | B. | c(CH3COO-)增大 | ||
| C. | CH3COOH的Ka不变 | D. | 溶液的pH增大 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 CH3COONa溶液:H+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
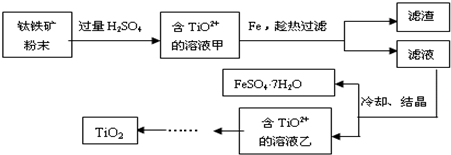
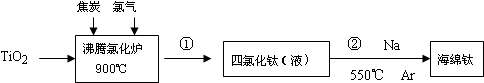

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
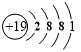 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO都是酸性氧化物 | D. | C2O3和CO2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>Q | |
| B. | Q分别与X、Z形成的最简单化合物中化学键类型相同 | |
| C. | YW能与WQ发生复分解反应 | |
| D. | 最简单气态氢化物的稳定性:X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题:
A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com