
已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ•mol﹣1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
则X、Y、Z的电负性从大到小的顺序为( )
|
| A. | Z>Y>X | B. | X>Z>Y | C. | X>Y>Z | D. | Y>Z>X |
考点:
元素电离能、电负性的含义及应用.
专题:
原子组成与结构专题.
分析:
根据同周期元素的电离能判断元素的种类,X的I4电离能突然增大,说明最外层有3个电子,应为Al,Y的I3电离能突然增大,说明最外层有2个电子,应为Mg,Z的I2电离能突然增大,说明最外层有1个电子,应为Na,根据同周期元素从左到右元素的电负性逐渐增强解答.
解答:
解:X的I4电离能突然增大,说明最外层有3个电子,应为Al,Y的I3电离能突然增大,说明最外层有2个电子,应为Mg,Z的I2电离能突然增大,说明最外层有1个电子,应为Na,
同周期元素从左到右元素的电负性逐渐增强,则有电负性Na<Mg<Al,
故选C.
点评:
本题考查元素电离能与电负性的递变,题目难度不大,本题注意根据电离能的变化判断元素核外电子排布为解答该题的关键,注意把握元素周期律的递变规律.


科目:高中化学 来源: 题型:
下列对阿伏加德罗定律及推论的理解不正确的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能大量共存的是( )
A.Na+、Al3+、NO3-、H+ B.Ba2+、Na+、Cl-、SO42-
C.Mg2+、H+、SO42-、OH- D.H+、Na+、CO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒的核外电子的表示方法中正确的是( )
|
| A. | 碳原子 |
|
| B. | P原子价电子轨道表示式 |
|
| C. | Cr原子的价电子排布式3d44s1 |
|
| D. | Fe2+价电子排布式3d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA为阿伏加德罗常数)( )
|
| A. | 124g P4含有P﹣P键的个数为4NA |
|
| B. | 12g石墨中含有C﹣C键的个数为3NA |
|
| C. | 12g金刚石中含有C﹣C键的个数为2NA |
|
| D. | 60g SiO2中含Si﹣O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(1)已知BA5为离子化合物,是由 、 两种微粒构成的(填化学符号).
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,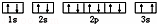 该同学所画的电子排布图违背了 .
该同学所画的电子排布图违背了 .
(4)G位于 族,G3+价电子排布式为 .GE3常温下为固体,熔点282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断GE3的晶体类型为 .
(5)DE3中心原子的杂化方式为 ,其空间构型为 .
(6)前四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式) ,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
3I﹣+S2O82﹣=I3﹣+2SO42﹣的反应速率可以用I3﹣与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I﹣)/mol•L﹣1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82﹣)/mol•L﹣1 | 0.040 | 0.040 | 0.080 | c1 | 0.080 |
| t/s | 88.0 | 44.0 | 22.0 | 22.0 | t2 |
下列说法不正确的是( )
|
| A. | 该实验的目的是探究I﹣与S2O82﹣浓度对反应速率的影响 |
|
| B. | 若在40℃下进行编号③对应浓度的实验,显色时间的范围为<22.0s |
|
| C. | 实验④c1=0.020 mol•L﹣1 |
|
| D. | 实验⑤显色时间t2=11 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关元素性质的说法不正确的是( )
|
| A. | 具有下列电子式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s222s2p63s23p4原子半径最大的是① |
|
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4对应的第一电离能最大是③ |
|
| C. | ①Na,K,Rb②N,P,As③O,S,Se④Na,P,Cl元素的电负性随原子序数增大而递增的是④ |
|
| D. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com