
【题目】下列说法正确的是( )
A.高锰酸钾溶液中,![]() 、
、![]() 、
、![]() 、葡萄糖分子能够大量共存
、葡萄糖分子能够大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() ,充分反应的离子方程式:
,充分反应的离子方程式:![]()
C.某温度下,![]() 的
的![]() 与
与![]() 混合溶液,一定存在
混合溶液,一定存在![]()
D.![]() ,已知
,已知![]() ,在
,在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]()
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.葡萄糖分子(HOCH2-CHOH-CHOH-CHOH-CHOH–CHO)中的手性碳原子数为4
B.氯化铯晶体中氯离子的配位数为8
C.![]() 的中心离子配位数为6
的中心离子配位数为6
D.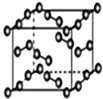 碘晶体中碘分子的排列方向种数为4
碘晶体中碘分子的排列方向种数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,![]() 废气的处理已成为研究的热点,图1是以
废气的处理已成为研究的热点,图1是以![]() 为主要原料的化工产品的生产过程。
为主要原料的化工产品的生产过程。

(1)关于侯氏制碱法,回答下列问题:
①写出![]() 的电子式______。
的电子式______。
②实验室制取![]() 的化学方程式______。
的化学方程式______。
③由侯氏制碱法获得![]() 分为两步:
分为两步:
I.![]()
II.______。
(2)尿素是重要的氮肥,请写出由![]() 生产尿素的化学方程式______。
生产尿素的化学方程式______。
(3)![]() 催化加氢制取汽油过程中发生如下反应:
催化加氢制取汽油过程中发生如下反应:
![]()
![]()
![]()
![]()
已知:在一定温度下,10L的密闭容器中,通入![]()
![]() 和
和![]()
![]() ,反应过程如图2所示,回答下列问题:
,反应过程如图2所示,回答下列问题:
①计算该温度下反应的平衡常数![]() ______。
______。
②下列可以判断该反应达到平衡状态的是______。
![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量
的减少量等于CO的生成量
![]() 反应容器内的压强不发生变化
反应容器内的压强不发生变化
![]() 混合气体中
混合气体中![]() 的浓度不再发生改变
的浓度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
2CrO42-+2H+,把重铬酸钾溶于水配成稀溶液是橙色的。
(1)向上述溶液中加入NaOH溶液,溶液呈__________色,因为_________。
(2)向已加入NaOH溶液的1中再加入过量稀硫酸,则溶液呈__________色,因为__________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡____________________,溶液颜色将____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关数据的比较,不正确的是()
A.元素的价电子数总等于所在族的族序数
B.NaOH晶体中阳离子和阴离子数目相等
C.CsCl晶体中每个![]() 周围紧邻的
周围紧邻的![]() 和每个
和每个![]() 周围紧邻的
周围紧邻的![]() 个数相等
个数相等
D.![]() 中的N原子数与配位键数相等
中的N原子数与配位键数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为![]() 和
和![]() ,其中
,其中![]() 属于____________(填“酸性”“碱性”或“两性”)氧化物;
属于____________(填“酸性”“碱性”或“两性”)氧化物;
②冶炼过程中需要用到氨,氨溶于水所得溶液呈____________(填“酸性”或“碱性”);
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取_____________(填“热还原法”或“电解法”)。
(2)工业上合成氨的反应为:![]() ,一定条件下,将
,一定条件下,将![]() 和
和![]() 置于
置于![]() 的密闭容器中,
的密闭容器中,![]() 后测得
后测得![]() 为
为![]() 。
。
①用![]() 表示该反应的速率为___________;
表示该反应的速率为___________;
②其他条件不变时,再通入![]() ,该反应的速率将_____________(填“增大”或“减小”)。
,该反应的速率将_____________(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题
将一定比例的三氧化硫和水混合可制得硫酸。硫酸是一种重要的化工原料,用途十分广泛,除用于化学工业外,还非常广泛应用于肥料、非碱性清洁剂、护肤品、油漆添加剂与炸药的制造等方面。
【1】关于浓硫酸的说法正确的是
A.易挥发
B.见光分解
C.密度比水的小
D.常温下能使铝片钝化,浓硫酸作氧化剂
【2】稀硫酸可以用于实验室制氢气,反应方程式为Zn+H2SO4=ZnSO4+H2↑,该反应的反应类型说法正确的是
A.化合反应B.复分解反应C.置换反应D.分解反应
【3】在其他条件不变的情况下,欲提高硫酸与锌反应产生氢气的速率,可以采用的措施有
A.选用颗粒更大的锌粒
B.升高反应温度
C.用98%浓硫酸来代替稀硫酸反应
D.加入硫酸钾溶液
【4】下列反应中,生成物总能量高于反应物总能量的是
A.S+O2![]() SO2
SO2
B.CaO+H2O=Ca(OH)2
C.C+CO2![]() 2CO
2CO
D.Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___(填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______(填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
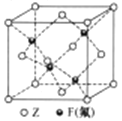
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1pm=1.0×10-12m)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室电解法制备LiOH,其工作原理如图所示,下列说法不正确的是( )

A.X电极连接电源正极
B.M为阴离子交换膜
C.Y电极反应式为![]()
D.制备2.4gLiOH产生的H2在标准状况下为1.12L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com