
分析 酸是指在电离时产生的阳离子全部是氢离子的化合物;
碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;
盐是由金属离子(或铵根离子)和酸根离子组成的化合物.
解答 解:A.酸是指在电离时产生的阳离子全部是氢离子的化合物,酸中不一定含有氧元素,如盐酸中不含氧元素,故错误;
B.碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,碱中一定含有氧元素,故正确;
C.盐是由金属离子(或铵根离子)和酸根离子组成的化合物,盐中不一定含有氧元素,如氯化钠中不含氧元素,故错误;
D.氧化物是只含有两种元素且其中一种元素是氧元素的化合物,一定含有氧元素;含氧酸是含有氧元素的酸,一定含有氧元素等.
故答案为:B;氧化物或含氧酸等.
点评 本题考查物质的分类,难度不大,掌握酸、碱、盐的概念与常见的酸、碱、盐的组成等是正确解答本题的关键.


科目:高中化学 来源: 题型:解答题
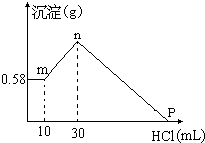
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
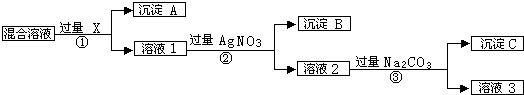
 ,沉淀A的晶体类型离子晶体,CO32-的空间构型是平面三角形.
,沉淀A的晶体类型离子晶体,CO32-的空间构型是平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | Na2SO3和盐酸 | C. | Na2S和HCl | D. | Na2SO3和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
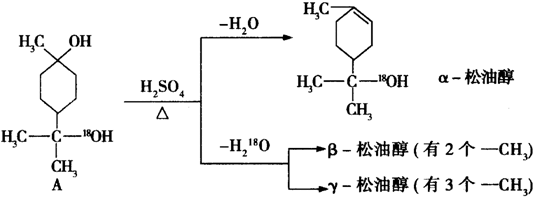
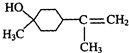 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$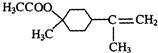 +H2O.
+H2O.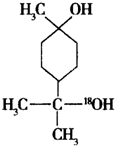 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$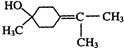 +H218O,该反应的反应类型是消去反应.
+H218O,该反应的反应类型是消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 反应开始20 s内以二氧化氮表示的平均反应速率为0.00125 mol/L•s | |
| B. | 80 s时向容器中加入0.32 mol氦气,同时将容器扩大为 4 L,则平衡将不移动 | |
| C. | 当反应达到平衡后,若缩小容器的体积,平衡向生成N2O4方向移动,气体的颜色变深 | |
| D. | 若其它条件不变,起始投料改为0.40 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
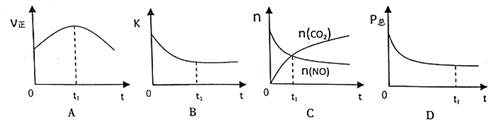
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
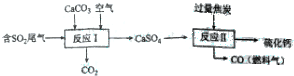
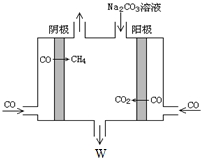
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com