
【题目】五味子丙素是我国首创的高效低毒的抗肝炎新药。联苯双酯是合成五味子丙素的中间体,其生产路线如下:
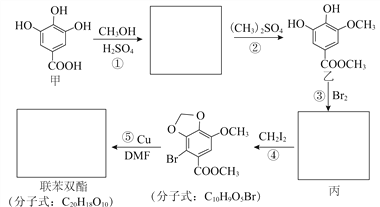
已知:卤代烃可以发生如右反应 R-X + R′-X→R-R′+ X2
回答下列问题:
(1)甲中的官能团名称为__________;反应①的反应类型为_____________。
(2)反应③除生成丙外,还生成等物质的量的HBr,反应④的化学方程式为_________。
(3)联苯双酯的结构简式为______________。
(4)乙有多种同分异构体,同时符合下列条件的有______种,请写出其中一种的结构简式_______。
a.苯环上有4个取代基,其中一个是 –OCH3;
b.与FeCl3溶液发生显色反应;
c.核磁共振氢谱为4组峰,且峰面积之比为2∶2∶3∶3。
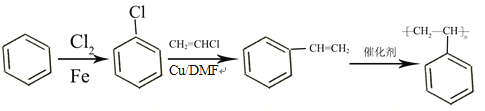
(5)参照上述合成路线及信息,以氯气、苯和氯乙烯为原料(其它试剂任选),设计制备聚苯乙烯的合成路线__________。
【答案】 (酚)羟基,羧基 取代反应(酯化反应)  +CH2I2→
+CH2I2→ + 2HI
+ 2HI 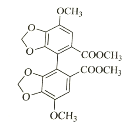 4
4 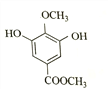 或
或 或
或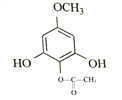 或
或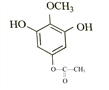
【解析】由已知结合流程可得,甲.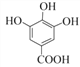 与CH3OH发生①酯化反应(取代反应),生成
与CH3OH发生①酯化反应(取代反应),生成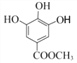 ;
; 与(CH3)2SO4发生②取代反应,生成乙.
与(CH3)2SO4发生②取代反应,生成乙.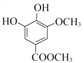 ;
; 与Br2发生③取代反应,生成丙.
与Br2发生③取代反应,生成丙. ;
; 与CH2I2发生④取代反应,生成
与CH2I2发生④取代反应,生成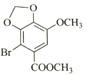 ;两分子
;两分子 发生⑤取代反应,生成联苯双酯.
发生⑤取代反应,生成联苯双酯.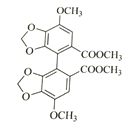 。
。
(1)甲为 ,含有羧基和(酚)羟基;由乙的结构简式
,含有羧基和(酚)羟基;由乙的结构简式 可得,
可得, 与CH3OH发生①酯化反应(取代反应),生成
与CH3OH发生①酯化反应(取代反应),生成 。
。
(2)因为反应③除生成丙外,还生成等物质的量的HBr,所以 与Br2发生③取代反应,生成丙.
与Br2发生③取代反应,生成丙. ;
; 与CH2I2发生④取代反应,生成
与CH2I2发生④取代反应,生成 ,化学方程式为:
,化学方程式为: +CH2I2→
+CH2I2→ +2HI。
+2HI。
(3)已知卤代烃可以发生反应:R-X+R′-X→R-R′+X2,所以两分子 发生⑤取代反应,生成联苯双酯.
发生⑤取代反应,生成联苯双酯. 。
。
(4)乙为 ,其同分异构体:“a.苯环上有4个取代基,其中一个是–OCH3”,–OCH3中有1种氢原子;“b.与FeCl3溶液发生显色反应”,则必有酚羟基;“c.核磁共振氢谱为4组峰,且峰面积之比为2∶2∶3∶3”,则还有两个取代基(其中一个为酚羟基,另一个为–OOCH3或–COOCH3),且苯环上有2个H,必等效。综上,符合条件的结构简式为:
,其同分异构体:“a.苯环上有4个取代基,其中一个是–OCH3”,–OCH3中有1种氢原子;“b.与FeCl3溶液发生显色反应”,则必有酚羟基;“c.核磁共振氢谱为4组峰,且峰面积之比为2∶2∶3∶3”,则还有两个取代基(其中一个为酚羟基,另一个为–OOCH3或–COOCH3),且苯环上有2个H,必等效。综上,符合条件的结构简式为: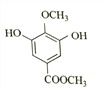 、
、 、
、 、
、 共4种。
共4种。
(5)已知卤代烃可以发生反应:R-X+R′-X→R-R′+X2,所以以氯气、苯和氯乙烯为原料制备聚苯乙烯,首先苯和氯气取代生成![]() ,然后
,然后![]() 与氯乙烯取代生成苯乙烯,最后苯乙烯发生加聚反应生成聚苯乙烯。合成路线如下:
与氯乙烯取代生成苯乙烯,最后苯乙烯发生加聚反应生成聚苯乙烯。合成路线如下: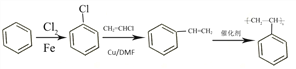 。
。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说正确的是( )
A.物质的量就是1摩尔物质的质量
B.1 mol水中含有2 mol氢和1 mol氧
C.1 molH2中含有6.02个氢分子
D.CO2的摩尔质量是44 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是( )

A. 若蓝、黑球原子的相对质量之比为4:3,则乙、丙两物质的摩尔质量之比为7:11
B. 若乙丙中蓝球元素显相同负价,则乙中黑球元素失去电子,被氧化
C. 若甲中黄球元素显正价,则丁为还原产物
D. 化学方程式中乙、丁的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)有很多用途。回答下列问题:
I.甲醇可用于制取甲醛(HCHO)。
(1)甲醇的沸点为64 ℃,甲醛的沸点为-21 ℃,甲醇的沸点较高的原因是__________。
(2)甲醇分子中采用sp3杂化的原子有____________(填元素符号);甲醛分子中σ键与π键之比为_____________。

II.直接甲醇燃料电池(DMFC)因其具有质量轻、体积小、结构简单、比能量密度高、低温操作等优点,DMFC阳极普遍采用以铂(Pt)为基础 的二元催化剂,如Pt-Cr合金等。
(3)基态Cr原子的未成对电子数为______________。
(4)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是_______。(填元素符号)
(5)已知金属铂晶胞结构如右图所示。催化剂的XRD图谱分析认为:当铂中掺入Cr原子后,Cr替代了晶胞面心位置上的Pt,该催化剂的化学式为_______,晶体中与1个Pt原子相紧邻的Cr原子有_____个。
(6)若铂原子半径为r pm,铂摩尔质量为M g·mol-1,铂晶体的密度为ρ g·cm-3,则阿伏加德罗常数NA为_____mol-1(用有关字母列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I构建和谐社会,建设社会主义新农村的目标之一是让农民饮用清洁的自来水。ClO2是新一代饮用水的消毒剂,许多发达国家采用ClO2代替C12进行自来水的消毒。请回答下列问题:
(1)消毒时单位质量的氧化剂得到电子的物质的量,叫其消毒效率, 已知ClO2、Cl2作消毒剂时均变为Cl—,则ClO2的消毒效率是Cl2的_________倍。
(2)制取ClO2的微观过程如图所示:

![]()
![]()
![]() (其中:
(其中: ![]() 表示钠原子,
表示钠原子, ![]() 表示氯原子,
表示氯原子, ![]() 表示氧原子)
表示氧原子)
该反应的化学方程式是 ___________________________________________________。
II. 德国化学家格哈德·埃特尔在固体表面化学的研究中取得了非凡的成就,其成果之一是揭示了氮气与氢气在催化剂表面合成氨的反应过程(下图所示)。其反应方程式为
“N2 + 3H2![]() 2NH3”,符合上述反应过程的顺序是_______.
2NH3”,符合上述反应过程的顺序是_______.
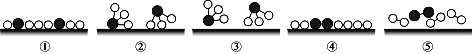
A.⑤④①③② B. ④⑤①②③ C. ④⑤①③② D. ⑤④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(mol·L-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________(只要求写表达式,不需计算)mol·L-1。
(2)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法错误的是( )
A. 除去混在植物油中的水——倾倒
B. 除去粗盐中的泥沙——过滤
C. 用乙醚提取中草药中的有效成分——萃取
D. 从海水中获得淡水——蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质。
(1)实验一:氢氧化钠标准溶液的配制。
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和______,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏_(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数。设计实验方案,将待测物理量和对应的测定方法填写在下表中。
待测物理量 | 测定方法 |
①_______ | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据。重复滴定2次。 |
②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用______测定溶液pH。 |
③ 上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为____________。
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响。
① 设计实验方案如下表,表中c=_______g。
编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
l | 乙酸 | 0.5 | 17.0 | 2.0 |
2 | 盐酸 | 0.5 | 17.0 | c |
② 实验步骤:
a)下图的装置中,在添加药品之前必须________;
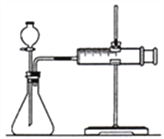
b)反应开始后,__________;
c)将所记录的欲据绘制成曲线图(下图)。

③ 写出镁与乙酸溶液反应的离子方程式:_______________。
④ 描述O~5min盐酸与镁条反应的反应速率变化规律:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com