
| A. | 第三周期元素的最高正化合价等于它所处的族序数 | |
| B. | 主族族序数与价电子数相同 | |
| C. | 非金属元素在化合物中既可显正价又可显负价 | |
| D. | 所有非金属元素的负化合价等于使原子达到8电子稳定结构所需得到的电子数 |
分析 A.原子结构决定元素的位置,可知第三周期中最外层电子数=最高正价=族序数;
B.主族元素的族序数与最外层电子数相同;
C.Cl元素在NaCl中为-1价,在NaClO中为+1价;
D.双氧水中O为-1价.
解答 解:A.原子结构决定元素的位置,可知第三周期中最外层电子数=最高正价=族序数,则第三周期元素的最高正化合价等于它所处的族序数,故A正确;
B.主族元素的族序数与最外层电子数相同,可知主族族序数与价电子数相同,故B正确;
C.非金属元素在化合物中既可显正价又可显负价,如Cl元素在NaCl中为-1价,在NaClO中为+1价,故C正确;
D.双氧水中O为-1价,水中O为-2价,即非金属元素的负化合价不一定等于使原子达到8电子稳定结构所需得到的电子数,故D错误;
故选D.
点评 本题考查元素周期表及应用,为高频考点,把握元素的性质、元素的位置和结构为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
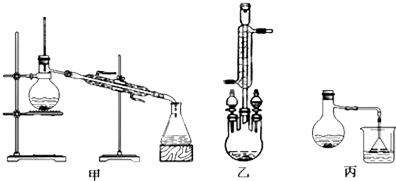
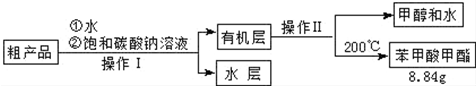
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学 | |
| B. | CO、H2CO3等含碳元素的化合物视作无机物的理由是他们的组成和性质跟无机物相似 | |
| C. | 迄今为止,人类发现和合成的有机物已超过3000万种 | |
| D. | 有机物受热不易分解,且不易燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
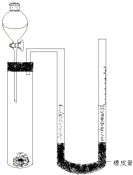 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 前20 min的平均反应速度$\overline v$(C)=0.1 mol/(L•min) | |
| B. | A的转化率为50% | |
| C. | C的平衡浓度c(C)=4 mol/L | |
| D. | B的平衡浓度c(B)=1.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,相同体积的SO2和SO3,质量比为4:5 | |
| B. | 相同状况下,质量相同的O2和O3,密度之比为3:2 | |
| C. | 相同质量的金刚石和石墨含有相同的C原子数和共价键数 | |
| D. | 标准状况下,相同体积的C2H2和C2H4,密度比为13:14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com