
| A. | H2O和H2O2两种分子中O原子的杂化类型相同 | |
| B. | NH3和NH4+两种微粒的空间结构相同 | |
| C. | SO42-和ClO4-两种微粒的键角相等 | |
| D. | SO2和O3两种分子是等电子体 |
分析 根据价层电子对互斥理论确定分子的空间构型及原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,据此分析解答ABC;
原子个数相等价电子数相等的微粒是等电子体,据此解答D.
解答 解:A、H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,H2O2中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,且含有2个孤电子对,所以O原子采用sp3杂化,两者杂化方式相同,故A正确;
B、氨气中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化,其空间构型为三角锥形结构,铵根离子中氮原子含有4个δ键且不含孤电子对,所以其采用sp3杂化,属于正四面体结构,两者空间结构不同,故B错误;
C、SO42-中,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb)=4+$\frac{1}{2}$(6+2-4×2)=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化,分子形状为正四面体形,ClO4-中价层电子对个数=4+$\frac{1}{4}$(7+1-4×2)=4,且不含孤电子对,所以是正四面体形,两者键角均为109°28′,故C正确;
D、原子个数相等价电子数相等的微粒是等电子体,SO2和O3原子个数均为3,价电子数均为6×3=18,故属于等电子体,故D正确,故选B.
点评 本题考查了原子杂化方式的判断、等电子体的概念,根据价层电子对互斥理论解答即可,注意孤电子对个数的计算方法,知道其表达式中各个字母的含义,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
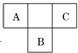 A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d区元素全部是金属元素 | B. | 第IA元素从上到下熔沸点依次降低 | ||
| C. | 短周期元素从左到右I1依次增大 | D. | 电负性最大的元素是He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | Cl-离子的结构示意图: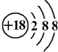 | D. | CH4分子的球棍模型: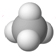 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 2 mol•L-1的醋酸钠溶液中CH3COO- 的数目小于2NA | |
| B. | 常温常压下,1.12 L O2气体所含原子数为0.1NA | |
| C. | 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA | |
| D. | 1 mol羟基含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.
甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com