
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
分析 A.1mol铁完全反应生成1mol氯化铁,转移的电子数目为3NA;
B.71g Cl2中含电子总数为$\frac{71g}{71g/mol}×34{N}_{A}$=34NA;
C.标准状况下,2.24L SO3是固体,不能用气体摩尔体积公式计算;
D.CnH2n+2分子中含有共价键数为3n+1.
解答 解:A.56g铁为1mol,1mol铁完全反应生成1mol氯化铁,反应失去了3mol电子,转移的电子数目为3NA,故A错误;
B.常温常压下,71g Cl2中含电子总数为$\frac{71g}{71g/mol}×34{N}_{A}$=34NA,故B正确;
C.标准状况下,2.24L SO3是固体,不能用气体摩尔体积公式计算,故C错误;
D.CnH2n+2分子中含有2n+2g个C-H键,n-1个C-C键,共价键数共为3n+1,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


科目:高中化学 来源: 题型:选择题
| A. | 干燥的液氯能用钢瓶贮存 | B. | 氯气和液氯是两种不同的物质 | ||
| C. | 可以用浓硫酸除去氯气中的水蒸气 | D. | 氯气曾在战争中被用于制造毒气弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体碘与NH4Cl的混合物可以用加热升华的方法分离 | |
| B. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| C. | 可以用米汤检验含碘食盐中的碘元素 | |
| D. | 水银洒落时,可在其表面覆盖一层硫粉进行处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若正反应是吸热反应,则A为非气态 | B. | 若正反应是吸热反应,则A为气态 | ||
| C. | 若正反应是放热反应,则A为气态 | D. | 若正反应是放热反应,则A为非气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | CuSO4 | C. | AgNO3 | D. | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
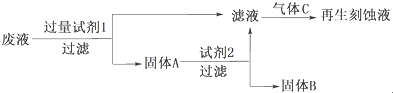
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡金属元素与非金属元素之间都形成离子键 | |
| B. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| C. | 含有离子键的化合物中,也可能还含有共价键 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com