
下列关于溶液的酸碱性,说法正确的是( )
A.pH=7的溶液呈中性
B.中性溶液中一定有[H+]=1.0×10-7 mol·L-1
C.[H+]=[OH-]的溶液呈中性
D.在100℃时,纯水的pH<7,因此显酸性
科目:高中化学 来源: 题型:
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
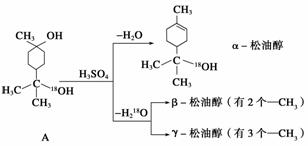
(1)α松油醇的分子式为__________。
(2)α松油醇所属的有机物类别是__________。
a.醇 b.酚 c.饱和一元醇
(3)α松油醇能发生的反应类型是______________。
a.加成 b.水解 c.氧化 d.取代
(4)写出结构简式:β松油醇____________________,γ松油醇
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
.一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )


A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.SO3的体积分数:II>III
D.容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=3的H2SO4和pH=12的NaOH溶液混合,当混合溶液的pH=10时,强酸和强碱的体积之比为( )
A.1∶9 B.9∶1 C.10∶1 D.1∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的HCl、H2SO4、CH3COOH各100 mL
(1)三种溶液中物质的量浓度最小的是________;
(2)分别用0.1 mol·L-1的NaOH溶液中和,其中消耗NaOH溶液最多的是________;
(3)稀释相同倍数,pH变化最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向淀粉溶液中加少量稀H2SO4,加热使淀粉水解,为测其水解程度,需要的试剂是( )
①NaOH溶液 ②银氨溶液 ③新制的Cu(OH)2悬浊液 ④碘水
A.④ B.②④ C.①③④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列,)根据要求回答下列各小题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中 4s 轨道上只有 1 个电子的元素有________(填元素名称)。
(2)写出基态 Cr3+的电子排布式:________。
(3)Fe3+ 的化学性质比Fe2+稳定,其原因是________。
(4)试比较:第一电离能I1(Cr)________(填“>”“<”或“=”)I1(Co)。
(5)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com