
| A. | NH3 | B. | H2S | C. | BeCl2 | D. | NO3- |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,空间构型为V形说明该微粒中含有2个孤电子对,据此判断.
解答 解:A.NH3分子中价层电子对=3+$\frac{1}{2}$(5-3×1)=4,采取sp3杂化方式,价层电子对互斥模型为四面体型,该分子中含有一个孤电子对,所以其空间构型为三角锥型,故A错误;
B.H2S分子中S原子价层电子对=2+$\frac{1}{2}$(6-2)=4,价层电子对互斥模型为四面体型,且含有2个孤电子对,所以S原子采用sp3杂化,为V形结构,故B正确;
C.BeCl2中价层电子对n=2+$\frac{2-1×2}{2}$=2,Be采取sp杂化,为直线型分子,故C错误;
D.NO3-中N原子形成3个σ键,孤对电子数=$\frac{5+1-3×2}{2}$,中心原子为sp2杂化,立体构型为平面三角形,故D错误;
故选B.
点评 本题考查了微粒空间构型的判断,题目难度不大,先根据价层电子对判断VSEPR模型,去掉孤电子对就是其实际空间构型,这是高考的热点、学习的重点.


科目:高中化学 来源: 题型:解答题
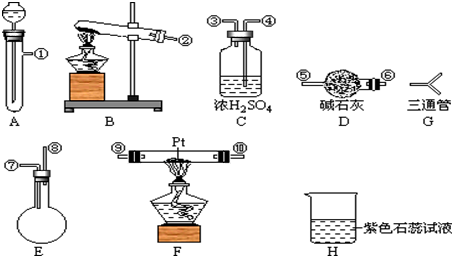
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
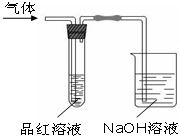 某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯使溴水褪色的原理不同 | |
| B. | 乙烯和聚乙烯中都有碳碳双键 | |
| C. | 煤的气化和液化都是化学变化 | |
| D. | 甲烷中混有乙烯时,仅用酸性KMnO4溶液不能提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )| A. | 氢氧化钡晶体和氯化铵晶体 | B. | 生石灰与水 | ||
| C. | 金属钠与水 | D. | 氯化钠与水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com