
【题目】草酸(![]() )广泛存在于食品中,人们对其及相关产品进行了深入研究。
)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)已知![]() 时,
时,![]() :
:![]() ,
,![]() 溶液显酸性。解释
溶液显酸性。解释![]() 溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
(2)已知反应:![]() ,为了使草酸分解,通过
,为了使草酸分解,通过![]() 燃烧反应提供能量:
燃烧反应提供能量:![]() ,已知分解的草酸与所需空气(其中氧气的体分数为
,已知分解的草酸与所需空气(其中氧气的体分数为![]() )的物质的量之比为
)的物质的量之比为![]() ,则
,则![]() ______
______
(3)草酸分解生成的![]() 燃料燃烧不足以提供足够的能量,还可通过甲烷来制备
燃料燃烧不足以提供足够的能量,还可通过甲烷来制备![]() 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为![]() 的
的![]() 和
和![]() ;在一定条件下发生反应
;在一定条件下发生反应![]() ,测得
,测得![]() 的平衡转化率与温度、压强的关系如下图1所示。
的平衡转化率与温度、压强的关系如下图1所示。

①由图判断压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的顺序为:______;该反应的
由小到大的顺序为:______;该反应的![]() ______0(填“<”“>”“=”):
______0(填“<”“>”“=”):
②![]() 该反应的平衡常数为______(结果保留两位小数)
该反应的平衡常数为______(结果保留两位小数)
(4)常温下,向![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]()
![]() 溶液,所得滴定曲线如图所示。下列说法正确的是______
溶液,所得滴定曲线如图所示。下列说法正确的是______
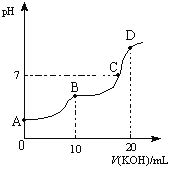
①![]() 点时:
点时:![]()
②![]() 点时:
点时:![]()
③![]() 点时:
点时:
④![]() 点时:
点时:![]()
【答案】NaHC2O4溶液存在电离平衡:HC2O4-![]() H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O
H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性 169.8 p4 >p3>p2>p1 > 6.55 ②③
H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性 169.8 p4 >p3>p2>p1 > 6.55 ②③
【解析】
(1)根据电离平衡常数计算HC2O4-的水解平衡常数,NaHC2O4溶液中HC2O4-电离程度大于其水解程度,溶液显酸性;
(2)草酸与所需空气(其中氧气的体分数20%)的物质的量之比为2:3,假设草酸为2mol,氧气为3mol×1/5=0.6mol;根据能量守恒关系列方程求解;
(3)①温度相同时,压强增大,平衡向逆反应方向移动,甲烷的转化率变小,由此判定压强大小顺序;压强不变,升高温度,甲烷的转化率增大,平衡右移,正反应为吸热反应;
②根据三段式求出平衡时各物质的浓度,以此求出该反应的平衡常数K。
(4)①A点时,为草酸溶液,溶液中存在电荷守恒;② B点时等物质的量的H2C2O4和KOH恰好反应生成KHC2O4;③![]() 点时:溶液呈中性,c(H+)=c(OH-),溶质为草酸钾和草酸氢钾的混合液,结合电荷守恒、物料守恒进行分析;④
点时:溶液呈中性,c(H+)=c(OH-),溶质为草酸钾和草酸氢钾的混合液,结合电荷守恒、物料守恒进行分析;④![]() 点时溶液为草酸钾,据以上情况进行分析。
点时溶液为草酸钾,据以上情况进行分析。
(1)NaHC2O4溶液中存在电离平衡:HC2O4-![]() H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O
H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于水解程度,溶液显酸性;
H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于水解程度,溶液显酸性;
综上所述,,本题答案是:NaHC2O4溶液存在电离平衡:HC2O4-![]() H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O
H++ C2O42-,电离平衡常数K2=5.4×10-5;水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性;
H2C2O4+OH-,水解平衡常数Kh=Kw/Ka1=10-14/(5.4×10-2)=1.85×10-13< K2;HC2O4-的电离程度大于HC2O4-的水解程度,溶液显酸性;
(2)已知分解的草酸与所需空气(其中氧气的体分数为![]() )的物质的量之比为2:3,假设草酸为2mol,则氧气为3mol×1/5=0.6mol;根据能量守恒关系可知:2×a=0.6×566,a=169.8;
)的物质的量之比为2:3,假设草酸为2mol,则氧气为3mol×1/5=0.6mol;根据能量守恒关系可知:2×a=0.6×566,a=169.8;
综上所述,本题答案是:169.8。
(3)①温度相同时,压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故p4 >p3>p2>p1;压强不变,升高温度,甲烷的转化率增大,平衡右移,正反应为吸热反应,H>0;
综上所述,本题答案是:p4 >p3>p2>p1;>。
②1100℃时,甲烷的转化率为80%,根据![]() 反应可知,剩余甲烷气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,二氧化碳气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,生成一氧化碳气体的浓度为2×0.2mol/L×80%=0.32mol/L,生成氢气气体的浓度为2×0.2mol/L×80%=0.32mol/L,所以该反应的平衡常数K=c2(H2)c2(CO)/[c(CH4)c(CO2)],带入数值计算可得:K=6.55;
反应可知,剩余甲烷气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,二氧化碳气体的浓度为0.2mol/L-0.2mol/L×80%=0.04mol/L,生成一氧化碳气体的浓度为2×0.2mol/L×80%=0.32mol/L,生成氢气气体的浓度为2×0.2mol/L×80%=0.32mol/L,所以该反应的平衡常数K=c2(H2)c2(CO)/[c(CH4)c(CO2)],带入数值计算可得:K=6.55;
综上所述,本题答案是:6.55。
(4)①A点时,为草酸溶液,溶液中存在电荷守恒:c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),错误;
② B点时等物质的量的H2C2O4和KOH恰好反应生成KHC2O4,溶液的pH小于7,说明KHC2O4溶液呈酸性,溶液中离子浓度大小关系为:c(K+)>c(HC2O4-)>c(H+)>c(OH-),正确;
③C点时:溶液呈中性,c(H+)=c(OH-),结合电荷守恒得c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+ c(OH-),所以c(K+)=c(HC2O4-)+2c(C2O42-);根据物料守恒可知,如果全为草酸氢钾溶液:c(K+)= c(HC2O4-)+c(C2O42-)+ c(H2C2O4);如果全为草酸钾溶液,c(K+)= 2[c(HC2O4-)+c(C2O42-)+ c(H2C2O4)];而题给混合液呈中性,为草酸氢钾和草酸钾的混合液,因此溶液中存在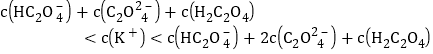 ;正确;
;正确;
④D点时:D点时,氢氧化钾的物质的量是草酸的2倍,二者恰好反应生成草酸钾,根据质子守恒:c(H+)+ c(HC2O4-)+2 c(C2O42-)=c(OH-),错误;综上所述,本题选②③。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是______;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
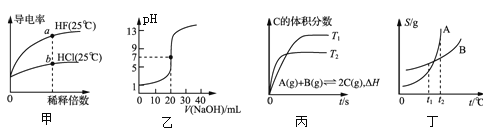
A. 由图甲可知,![]() 点Kw的数值比
点Kw的数值比![]() 点Kw的数值大
点Kw的数值大
B. 乙表示![]()
![]() 溶液滴定
溶液滴定![]()
![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
C. 丙表示在相同的密闭容器中,不同温度下的反应,该反应的![]()
D. 丁表示![]() 、
、![]() 两物质的溶解度随温度变化情况,将
两物质的溶解度随温度变化情况,将![]() 时
时![]() 、
、![]() 的饱和溶液分别升温至
的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
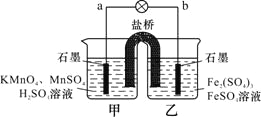
A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列一句话中叙述了两个值,前者记为![]() ,后者记为
,后者记为![]() ,
,![]() 和
和![]() 的关系从A、B、C、D中选择,并填空。
的关系从A、B、C、D中选择,并填空。
A.![]() B.
B.![]() C.
C.![]() D.无法比较
D.无法比较
(1)常温下![]() 的
的![]() 与
与![]()
![]() 等体积混合后溶液中
等体积混合后溶液中![]() 和
和![]() :______;
:______;
(2)同温度下,![]()
![]() 溶液中
溶液中![]() 水解百分率与
水解百分率与![]() 溶液中
溶液中![]() 的水解百分率:______;
的水解百分率:______;
(3)pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的![]() 倍和
倍和![]() 倍,稀释后两溶液的
倍,稀释后两溶液的![]() 值仍然相同,则
值仍然相同,则![]() 和
和![]() 的关系是:______;
的关系是:______;
(4)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中![]() :______;
:______;
(5)相同温度下,![]() 值为12的烧碱溶液中水的电离度和
值为12的烧碱溶液中水的电离度和![]() 值为12的
值为12的![]() 溶液中水的电离度:______;
溶液中水的电离度:______;
(6)将![]() 值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的
值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的![]() 值:______;
值:______;
(7)室温下某强酸和某强碱溶液等体积混合后,溶液的![]() 值为7,原酸溶液和原碱溶液的物质的量浓度:______;
值为7,原酸溶液和原碱溶液的物质的量浓度:______;
(8)相同温度下,![]() 的
的![]() 溶液中的
溶液中的![]() 个数和
个数和![]()
![]() 溶液中
溶液中![]() 的个数:______。
的个数:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
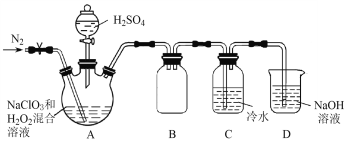
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_______________________________。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________________作指示剂,用0.100 0 mol![]() L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol
L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol![]() L-1。
L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
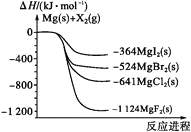
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20世纪90年代末期,科学家发现并证明碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是

A. 熔点比较: ![]()
B. ![]() 、
、![]() 、管状碳和洋葱状碳之间的转化属于化学变化
、管状碳和洋葱状碳之间的转化属于化学变化
C. ![]() 晶体结构如上图所示,每个
晶体结构如上图所示,每个![]() 分子周围与它最近且等距离的
分子周围与它最近且等距离的![]() 分子有12个
分子有12个
D. ![]() 、
、![]() 、管状碳和洋葱状碳都不能与
、管状碳和洋葱状碳都不能与![]() 发生反应
发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com