
| A. | 酸性:H2SiO3<H2CO3 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:SiH4>PH3 | D. | 原子半径:N<C |
分析 A.非金属性越强,最高价氧化物对应水化物的酸性越强;
B.金属性越强,最高价氧化物对应水化物的碱性越强;
C.非金属性越强,气态氢化物越稳定;
D.同周期随着原子序数的递增,半径减小.
解答 解:A.同主族中非金属性C>Si,故酸性酸性:H2SiO3<H2CO3,故A正确;
B.金属性Mg>Al,故碱性碱性:Mg(OH)2>Al(OH)3,故B正确;
C.非金属氢Si<P,故气态氢化物的稳定性为SiH4<PH3,故C错误;
D.同周期随着原子序数的递增,半径减小,N<C,故D正确;
故选ABD.
点评 本题考查非金属元素在周期表中的位置及其性质递变规律,根据元素在周期表中的位置及元素周期律确定元素非金属性强弱,再结合非金属的非金属性强弱与其最高价含氧酸酸性的关系解答即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | Na2O+2H2O═2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
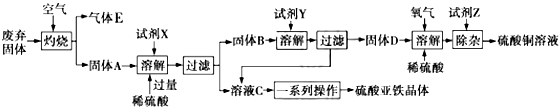
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S) | |
| B. | 浓度为0.1mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1 ②3s23p2 ③3s23p3④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
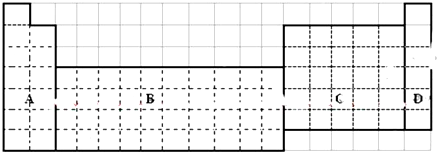
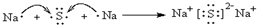 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com