
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X2YZ3 |
科目:高中化学 来源: 题型:选择题

| A. | a点溶液A、B的物质的量浓度相等 | |
| B. | 通常采用降温结晶的方法获得晶体B | |
| C. | 用蒸发浓缩、趁热过滤从C的溶液中分离出晶体C | |
| D. | 30℃时,A的饱和溶液的质量分数约为35% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 4 | D. | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2 (g)+O2 (g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. |  表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2 C2 O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 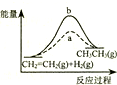 图中a、b曲线分别表示反应CH2=CH2 (g)+H2 (g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一切物质中均有化学键 | |
| B. | 离子化合物中可能含有极性键,共价化合物中不可能含有离子键 | |
| C. | 只由共价键构成的物质一定为共价化合物 | |
| D. | 主族元素的最高正化合价都等于其最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氧化亚铁通入盐酸中:FeO+2H+═Fe2++H2O | |
| B. | 将少量的铜屑放入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| C. | 在澄清的石灰水中通入过量SO2:SO2+OH-═HSO3- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol.L-1NaCl溶液中Na+的数目为0.1NA | |
| B. | 标准状况下,11.2 L H2O中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 1 mol Na被完全氧化生成Na2O2,失去个电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com