
下列说法正确的是
A.已知Ksp[Fe(OH)3]=4.0×10—38,则常温下Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10—5
Fe(OH)3+3H+的平衡常数K=2.5×10—5
B.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L—1的NaOH标准溶液
C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D.催化剂通过降低化学反应的焓变加快化学反应速率
科目:高中化学 来源: 题型:
25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5 518 kJ/mol。下列热化方程式书写正确的是( )
A.2H+(aq)+SO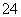 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
B.KOH(aq)+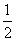 H2SO4(aq)===
H2SO4(aq)===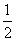 K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
C.C8H18(l)+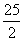 O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
|
| A. | 0.1mol•L﹣1的Na2CO3溶液中含CO32﹣为0.1NA |
|
| B. | 3.2 g O2和O3的混合气中氧原子数为0.2NA |
|
| C. | 1mol H3O+含质子数为10 NA |
|
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2﹣.为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I﹣=I2+2ClO2﹣,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2﹣+4H+=2I2+Cl﹣+2H2O,反应结束后叉产生b mol I2.饮用水中c(ClO2﹣)= 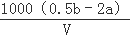 mol•L﹣ 1(用含字母的代数式表示).
mol•L﹣ 1(用含字母的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.CuCl2溶液中加入少量氨水:Cu2++2OH-=Cu(OH)2↓
B.向酸性KMnO4溶液中通入SO2:3SO2+2MnO +4OH-=2MnO2↓+3SO42-+2H2O
+4OH-=2MnO2↓+3SO42-+2H2O
C.电解饱和MgCl2溶液:2Cl-+2H2O  2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向Na2SO3溶液中滴加足量NaClO溶液:SO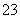 + ClO-= SO
+ ClO-= SO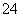 + Cl-
+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
 (2)NaClO3的作用是 。
(2)NaClO3的作用是 。
(3)加Na2CO3调pH至5.2所得沉淀为
。
(4)萃取剂对金属离子的萃取率与pH的关系如图。
萃取剂的作用是 ;
其使用的较适宜pH范围是 。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质
量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应 :
:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
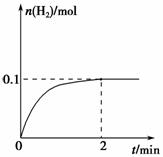 (2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率
v(HI)=________。该温度下,
H2(g)+I2(g) 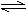 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应起了氮的固定作用的是( )
A.N2和H2在一定条件下反应生成NH3
B.NH3经催化氧化生成NO
C.NO和O2反应生成NO2
D.由NH3制碳铵或氯铵
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com