
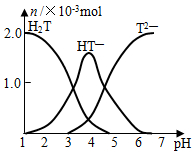
 常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系.下列说法正确的是( )
常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系.下列说法正确的是( )| A、VNaOH=10mL时,溶液中存在[Na+]=2[H2T]+2[HT-]+2[T2-] |
| B、VNaOH=20mL时,溶液中存在[Na+]>[HT-]>[H+]>[H2T]>[T2-] |
| C、VNaOH=30mL时,溶液中存在[Na+]>[HT-]>[T2-]>[OH-]>[H+] |
| D、VNaOH=40mL时,溶液中存在[OH-]=[HT-]+2[H2T]+[H+] |


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
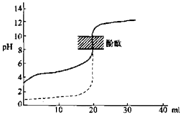 下列说法正确的是( )
下列说法正确的是( )| A、0.1 mol?L-1的Na2S溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| B、如图是用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和体积均相同的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、HA是酸性略强与醋酸的弱酸,在0.1 mol?L-1 NaA溶液中,离子浓度关系可能是c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾可用作除去污水中悬浮颗粒的混凝剂 |
| B、棉花、羊毛、腈纶和涤纶都属于合成纤维 |
| C、使用青霉素前一定要进行皮肤敏感试验 |
| D、利用油脂在碱性溶液中的水解可制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B、明矾溶液中滴加Ba(OH)2溶液至SO42-恰好完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓ |
| C、200mL 2mol?L-1的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
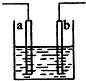 如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )
如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )| A、a、b不可能是同种材料的电极 |
| B、该装置可能是原电池,电解质溶液为稀盐酸 |
| C、该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸 |
| D、该装置可能是电解池,电解质溶液为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液:K+、Ca2+、HCO3-、NO3- |
| B、能使淀粉碘化钾试纸变蓝的溶液:K+、I-、SO42-、NO3- |
| C、使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- |
| D、能够溶解Al且放出H2的溶液:NH4+、K+、Br-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L NO和22.4L O2的混合,混合气体中含有的氧原子数为3NA | ||||
| B、0.012kg 13C中,含中子数为7NA | ||||
| C、25℃时,1L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 | ||||
D、在反应3SiO2+6C+2N2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com