

分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)B中的液体不能与二氧化硫反应,据此进行分析;
(3)二氧化硫能够与硫化氢反应生成淡黄色的硫单质;二氧化硫具有漂白性,能够使品红溶液褪色.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)装置B可作储气之用,称之为储气瓶,储存的气体为二氧化硫,所以B中广口瓶内应盛放的液体不能与二氧化硫反应,而②酸性KMnO4、③NaHCO3溶液、④NaOH溶液都与二氧化硫反应,不符合条件,只有①满足条件,
故答案为:①;
(3)装置C中盛有硫化钠,二氧化硫能够与硫化钠溶液反应生成S单质,所以C中有淡黄色沉淀产生;二氧化硫气体具有漂白性,所以装置D中的品红溶液褪色,
故答案为:有淡黄色沉淀产生;品红溶液褪色.
点评 本题考查了浓硫酸的性质,题目难度不大,明确铜与浓硫酸的反应原理及二氧化硫的性质、检验方法即可解答,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
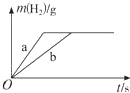
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
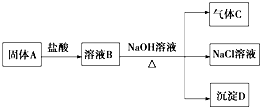
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
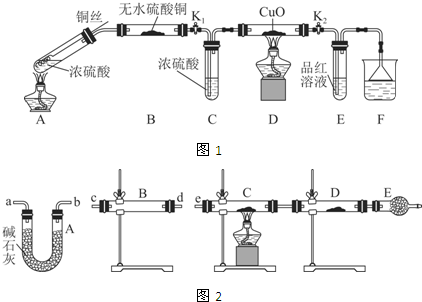
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
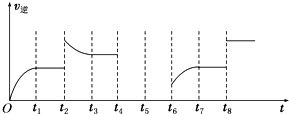 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1、2 | B. | 2、3 | C. | 3、6 | D. | 4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
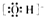
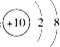

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com