
分析 (1)反应速率之比等于化学计量数之比;
(2)①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
结合盖斯定律可知,$\frac{①-②}{2}$得到NO2(g)+SO2(g)?SO3(g)+NO(g);
(3)结合平衡的特征“等、定”及衍生的物理量判定平衡状态.
解答 解:(1)2SO2(g)+O2(g)?2SO3(g)中反应速率v(SO2)=0.05mol•L-1•min-1,由速率之比等于化学计量数之比可知,v(O2)=0.05mol•L-1•min-1×$\frac{1}{2}$=0.025mol•L-1•min-1,故答案为:0.025;
(2)①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
结合盖斯定律可知,$\frac{①-②}{2}$得到NO2(g)+SO2(g)?SO3(g)+NO(g),其△H=$\frac{(-196kJ/mol)-(-113kJ/mol)}{2}$=-41.8kJ/mol,
故答案为:-41.8;
(3)a.该反应为气体体积不变的反应,则体系压强始终保持不变,不能判定平衡状态,故a不选;
b.混合气体颜色保持不变,可知NO2的浓度不变,为平衡状态,故b选;
c.开始时NO2与SO2以体积比1:2,以1:1参加反应,则NO2和SO2的体积比保持不变,为平衡状态,故c选;
d.△H与反应进行的程度无关,始终保持不变,不能判定平衡状态,故d不选;
故答案为:b、c.
点评 本题考查较综合,涉及反应热与焓变、反应速率、平衡判定,为高频考点,把握盖斯定律的应用、速率与化学计量数的关系、平衡特征为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;侧三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a+b)KJ•mol-1 | B. | (a-b)KJ•mol-1 | ||
| C. | (a+3b)KJ•mol-1 | D. | (0.5a+1.5b)KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
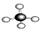 ②乙烯 ③CH3CH2OH ④CH2=CH-CH3 ⑤
②乙烯 ③CH3CH2OH ④CH2=CH-CH3 ⑤
| A. | ①⑤ | B. | ①③④⑤ | C. | ①④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com