
分析 醋酸是弱电解质,在溶液中部分电离,电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商.
解答 解:醋酸是弱电解质,在溶液中部分电离,则电离方程式为CH3COOH?H++CH3COO-,电离平衡常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$;
故答案为:CH3COOH?H++CH3COO-;Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$.
点评 本题考查了电离方程式的书写、电离平衡常数表达式,题目难度不大,注意掌握强电解质与弱电解质的判断方法,能够根据电离方程式的书写原则正确书写常见的电解质的电离方程式.


科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑤ | C. | ①④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该星球表面温度很高 | |
| B. | 该星球表面温度很低 | |
| C. | 低温下稳定性CH2=CHOH>CH3CHO | |
| D. | 该反应中CH2=CHOH化学键断裂吸收能量大于CH3CHO化学键形成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | a、b、c三点所示溶液中水的电离程度c>a>b | |
| D. | 图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
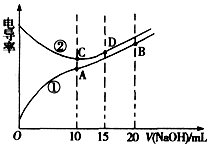
| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol.L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Na2S2O3起始读数 | Na2S2O3 终点读数 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com