
 扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.
扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.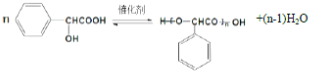 .
. .
.分析 (1)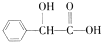 中含-OH、-COOH;
中含-OH、-COOH;
(2)根据结构简式确定分子式;
(3)羟基能与羧基发生酯化反应;
(4)能发生银镜反应说明含有醛基.
解答 解:(1)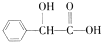 中含-OH、-COOH,其名称为羟基、羧基,故答案为:羟基、羧基;
中含-OH、-COOH,其名称为羟基、羧基,故答案为:羟基、羧基;
(2)根据结构简式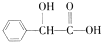 ,可知分子式为C8H8O3,故答案为:C8H8O3;
,可知分子式为C8H8O3,故答案为:C8H8O3;
(3)羟基能与羧基发生酯化反应,化学方程式 ,故答案为:
,故答案为: ;
;
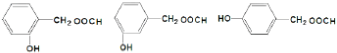
(4)能发生银镜反应说明含有醛基,结合①含酯基且能发生银镜反应;②羟基直接连在苯环上;③苯环上只有2个取代基,可知同分异构体为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的合成及有机物的结构与性质,熟悉常见有机物的官能团及性质是解答本题的关键,题目难度中等,(4)为解答的易错点.


科目:高中化学 来源: 题型:选择题
| A. | 推广可利用太阳能、风能的城市照明系统 | |
| B. | 使用露天焚烧法处理未经分类的生活垃圾 | |
| C. | 加速建设地铁、轻轨等轨道交通,减少汽车尾气排放 | |
| D. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=CH2 | B. | CH3COOH | C. | CH2=CHClC=CH2 | D. | CH2=CHCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
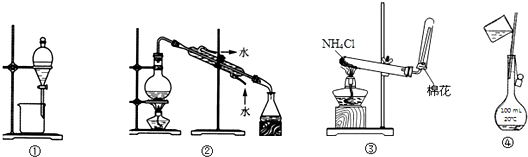
| A. | 选①可用于CC14提取碘水中的碘 | |
| B. | 选②可用于自来水制取蒸馏水 | |
| C. | 选③可用于实验室制取氨气 | |
| D. | 选④可用于配制100 mL 0.1 mol/L NaCl溶液(转移溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
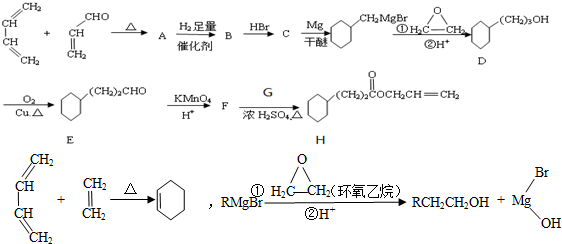
 ,G物质核磁共振氢谱共有4个峰.
,G物质核磁共振氢谱共有4个峰. .写出D生成E的化学方程式
.写出D生成E的化学方程式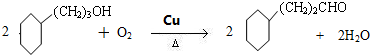 .
.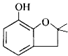 呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式:
呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: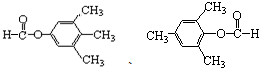 .
.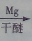 CH3CH2MgBr
CH3CH2MgBr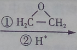 CH3CH2CH2CH2OH.
CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com