
【题目】Ⅰ.(1)在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g) ![]() cC(s)+dD(g),平衡时测得A的浓度为0.60 mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20 mol/L。下列有关判断一定正确的是
cC(s)+dD(g),平衡时测得A的浓度为0.60 mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20 mol/L。下列有关判断一定正确的是
A.平衡向正反应方向移动 B.A的转化率增大
C.D的体积分数增大 D.a+b<c+d
(2)①25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=__________________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为:_______________。
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
Ⅱ.0.98 gCu(OH)2样品受热分解的热重曲线(样品质量随温度变化的曲线)如图所示。

请回答下列问题:
(1)试确定1 100 ℃时所得固体B的化学式(要求写出推理或计算过程)。
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体反应,得到红色固体单质和气体单质,则该反应的化学方程式为:____________________;若反应中转移0.015 mol电子,则消耗还原剂的物质的量为________________。
(3)取少量固体B于试管中,加入足量的稀硫酸得到蓝色溶液,同时观察到试管中还有红色固体存在,该反应的离子方程式为:_____________。
【答案】Ⅰ.(1)D;
(2)①K=![]()
②H2SO3+HCO3-===CO2↑+H2O+HSO3-
③HSO3-既能水解又能电离,HSO3-的电离常数Ka2=6.3×10-8。设水解平衡常数为Kh,则Kh=![]() =
=![]() =
= ![]() =
=![]() ≈7.7×10-13<Ka2。由此可知HSO3-电离程度大于水解程度,其溶液显酸性。
≈7.7×10-13<Ka2。由此可知HSO3-电离程度大于水解程度,其溶液显酸性。
Ⅱ:(1)0.98 g Cu(OH)2即0.01 mol,加热至1 100 ℃时失重0.26 g ,则1 mol Cu(OH)2加热至1 100 ℃时失重26 g,加热时失去的重量应为2 mol H原子和1.5 mol O原子,则1 mol Cu(OH)2加热后剩余1 mol Cu和 0.5 mol氧原子,Cu与O原子个数比为2∶1,故剩余固体化学式为Cu2O。
(2)3CuO+2NH33Cu+N2+3H2O 0.005 mol (3)Cu2O+2H+===Cu+Cu2++H2O
【解析】
试题分析:Ⅰ.(1)平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,测得A的浓度降为0.20mol/L,则平衡不移动,则说明降低压强平衡不移动,则A.根据上述分析,平衡不移动,故A错误;降低压强平衡向逆方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为x+y>z,故A错误;B.由以上分析可知平衡不移动,A的转化率不变,故B错误;C.平衡不移动,则D的体积分数不变,故C错误;D.平衡不移动,则a+b=d,故推z+b<c+d,故D正确;故选D;
(2)①HSO3-的电离方程式为:HSO3-![]() H++SO32-,平衡常数表达式为K=
H++SO32-,平衡常数表达式为K=![]() ,故答案为:
,故答案为:![]() ;
;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
③HSO3-既能水解又能电离,HSO3-的电离常数Ka2=6.3×10-8,HSO3-+H2OH2SO3+OH-,设水解平衡常数为Kh,则Kh=![]() =
=![]() ≈7.7×10-13<Ka2,由此可知HSO3-电离程度大于水解程度,其溶液呈酸性,故答案为:NaHSO3溶液显酸性
≈7.7×10-13<Ka2,由此可知HSO3-电离程度大于水解程度,其溶液呈酸性,故答案为:NaHSO3溶液显酸性
Ⅱ.(1)由图可知0.98gCu(OH)2即0.01mol,加热至1100°C时失重0.26g,则1mol Cu(OH)2加热至1100°C时失重26g,加热时失去的重量应为2molH原子和1.5molO原子,则1molCu(OH)2加热后剩余1molCu和 0.5mol氧原子,Cu与O原子个数比为2:1,故剩余固体化学式为Cu2O,故答案为:Cu2O;
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体是氨气,得到红色固体单质是铜和气体单质是氮气,所以反应的化学方程式为:3CuO+2NH3![]() 3Cu+N2+3H2O;每转移6mol的电子消耗还原剂为2mol,反应中转移0.015mol电子,则消耗还原剂的物质的量为
3Cu+N2+3H2O;每转移6mol的电子消耗还原剂为2mol,反应中转移0.015mol电子,则消耗还原剂的物质的量为![]() ×0.015=0.005mol,故答案为:3CuO+2NH3
×0.015=0.005mol,故答案为:3CuO+2NH3![]() 3Cu+N2+3H2O; 0.005mol;
3Cu+N2+3H2O; 0.005mol;
(3)取少量固体氧化亚铜于试管中,加入足量的稀硫酸得到蓝色溶液含铜离子,同时观察到试管中还有红色固体存在是单质铜,是酸性条件下+1价铜发生自身的氧化还原反应,离子方程式为Cu2O+2H+═Cu+Cu2++H2O,故答案为:Cu2O+2H+═Cu+Cu2++H2O。


科目:高中化学 来源: 题型:
【题目】Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象 ;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 ;
(3)MnO2加入双氧水中放出气泡更快 .
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
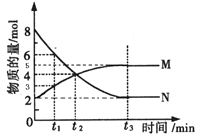
(1)比较t2时刻,正逆反应速率大小V正 V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为: .
(3)t3时刻化学反应达到平衡,反应物的转化率为 .
(4)如果升高温度,则V逆 (填增大、减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 丙烯酸的结构简式为CH2=CH—COOH,下列说法不正确的是
A.能与新制的Cu(OH)2悬浊液反应
B.能发生加聚反应生成高分子化合物
C.能与新制银氨溶液发生银镜反应
D.与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法错误的是
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 水玻璃可用于生产黏合剂和防火剂
C. 煤的干馏和石油的分馏均属物理变化
D. 漂白粉长期暴露在空气中会变质失效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是( )
A.MgO固体(Al2O3) B.Na2CO3固体(NaHCO3)
C.FeCl2溶液(CuCl2) D.Fe2O3固体(SiO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
Na | Cu | Al | Fe | |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点(℃) | 883 | 2595 | 2200 | 3000 |
根据以上数据判断其中不能形成合金的是( )
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中盛有一定量的CH4与O2混合气体及足量的Na2O2固体,电火花点燃充分反应后,恢复至室温,发现容器为真空,则原混合气中CH4与O2的体积比为( )
A.2:1 B.1:2 C.1:1 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
Ⅰ.煅烧硫铁矿(主要成分为FeS2)的反应为:
4FeS2+11O2 ![]() 2Fe2O3+8SO2。试回答下列问题。
2Fe2O3+8SO2。试回答下列问题。
(1)可用哪些物质来表示该反应的化学反应速率__________ 。
(2)某时刻时测得,生成SO2的速率为0.64 mol/(Ls),则氧气减少的速率为_______ mol/(Ls)。
(3)该工业生产中将矿石粉碎的目的:
。
Ⅱ.当运动员肌肉受伤时,队医会随即对准运动员的受伤部位喷射药剂氯乙烷,进行局部冷冻麻醉处理。
(1)制取氯乙烷 (CH3CH2Cl)的最好的方法是 。
a.乙烷与氯气发生取代反应
b.乙烯与氯气发生加成反应
c.乙烷与氯化氢反应
d.乙烯与氯化氢发生加成反应
(2)写出所选反应的化学方程式: 。
Ⅲ.某钢铁厂高炉炼铁的主要反应过程如下:
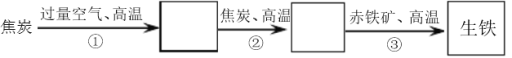
(1)写出步骤②③的化学方程式:
② ;
③ 。
(2)下列有关高炉炼铁的说法正确的是 。
a.增加高炉的高度可以提高CO的利用率
b.三个反应均为吸热反应
c.从高炉炉顶出来的气体中含有没有利用的CO气体
d.只有步骤②的反应是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜、锌和稀硫酸组成的原电池的说法正确的是( )

A.铜的表面没有气泡产生
B.电子从溶液中由锌向铜定向移动
C.该原电池利用电能使锌与硫酸发生反应
D.该原电池工作一段时间后,溶液中c(H+)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com