
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2(g)+![]() O2(g)��H2O(l) ��H��-285kJ/mol
O2(g)��H2O(l) ��H��-285kJ/mol
��H2(g)+![]() O2(g)��H2O(g) ��H��-241.8kJ/mol
O2(g)��H2O(g) ��H��-241.8kJ/mol
��C(s)+![]() O2(g)��CO(g) ��H��-110.4 kJ/mol
O2(g)��CO(g) ��H��-110.4 kJ/mol
��C(s)+O2(g)��CO2(g) ��H��-393.5 kJ/mol
�ش����и��ʣ�
��1��������Ӧ�����ڷ��ȷ�Ӧ����__��
��2��C��ȼ����Ϊ___��
��3��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ___��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ___��
��5��Ϊ�˿�������ЧӦ��������ѧ������˲������롣���˸���Һ̬CO2�ܶȴ��ں�ˮ�ܶȵ���ʵ�����뽫CO2Һ������������ף��Լ��ٴ����е�CO2��ΪʹCO2Һ�����ɲ�ȡ�Ĵ�ʩ__��
a.��ѹ������ b.��ѹ������ c.��ѹ������ d.��ѹ������
��6��д�����з�Ӧ���Ȼ�ѧ����ʽ��N2(g)������H2(g)��Ӧ������2molNH3(g)���ų�92.2kJ����___��
���𰸡��٢ڢۢ� 393.5kJ/mol 1425kJ CO(g)+![]() O2(g)��CO2(g) ��H��-283.1kJ/mol b N2(g)��3H2(g)=2NH3(g) ��H����92.2kJ��mol��1
O2(g)��CO2(g) ��H��-283.1kJ/mol b N2(g)��3H2(g)=2NH3(g) ��H����92.2kJ��mol��1
��������
��1��������Ӧ�����ڷ��ȷ�Ӧ������H<0�ķ�Ӧ��
��2���ӡ�C(s)+O2(g)��CO2(g) ��H��-393.5 kJ/mol���ɵó�C��ȼ���ȡ�
��3��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ285kJ/mol��5mol��
��4����C(s)+![]() O2(g)��CO(g) ��H��-110.4 kJ/mol
O2(g)��CO(g) ��H��-110.4 kJ/mol
��C(s)+O2(g)��CO2(g) ��H��-393.5 kJ/mol
��-�ۿɵó�COȼ�յ��Ȼ�ѧ����ʽ��
��5��ΪʹCO2Һ�����ɲ�ȡ�Ĵ�ʩ��ѹ�����¡�
��6�����з�Ӧ���Ȼ�ѧ����ʽ��N2(g)������H2(g)��Ӧ������2molNH3(g)���ų�92.2kJ���������Ȼ�ѧ����ʽΪN2(g)+3H2(g) ![]() 2NH3(g) ��H����92.2kJ��mol��1��
2NH3(g) ��H����92.2kJ��mol��1��
��1��������Ӧ�����ڷ��ȷ�Ӧ���Ǣ٢ڢۢܡ���Ϊ���٢ڢۢܣ�
��2���ӡ�C(s)+O2(g)��CO2(g) ��H��-393.5 kJ/mol���ɵó�C��ȼ����Ϊ393.5kJ/mol��
��3��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ285kJ/mol��5mol=1425kJ����Ϊ��1425kJ��
��4����C(s)+![]() O2(g)��CO(g) ��H��-110.4 kJ/mol
O2(g)��CO(g) ��H��-110.4 kJ/mol
��C(s)+O2(g)��CO2(g) ��H��-393.5 kJ/mol
��-�ۿɵó�COȼ�յ��Ȼ�ѧ����ʽCO(g)+![]() O2(g)��CO2(g) ��H��-283.1kJ/mol����Ϊ��CO(g)+
O2(g)��CO2(g) ��H��-283.1kJ/mol������CO(g)+![]() O2(g)��CO2(g) ��H��-283.1kJ/mol��
O2(g)��CO2(g) ��H��-283.1kJ/mol��
��5��ΪʹCO2Һ�����ɲ�ȡ�Ĵ�ʩ��ѹ�����£���ѡb����Ϊ��b��
��6��д�����з�Ӧ���Ȼ�ѧ����ʽ��N2(g)������H2(g)��Ӧ������2molNH3(g)���ų�92.2kJ���������Ȼ�ѧ����ʽΪN2(g)+3H2(g) ![]() 2NH3(g) ��H����92.2kJ��mol��1����Ϊ��N2(g)+3H2(g)
2NH3(g) ��H����92.2kJ��mol��1������N2(g)+3H2(g) ![]() 2NH3(g) ��H����92.2kJ��mol��1��
2NH3(g) ��H����92.2kJ��mol��1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1��Ŀǰ��Ӧ����㷺���������������ѳ�������NH3����ԭ������ѧ��Ӧ�ɱ�ʾΪ��2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) ��H��0
�ٸ÷�Ӧ�У���Ӧ��������_____������>������<������=������������������
�ڵ��÷�Ӧ��2mol N2(g)����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ____________mol��
�۸÷�Ӧ�У���ԭ��Ϊ_____________���ѧʽ�������������뻹ԭ�����������Ϊ______________��
��2��Ҳ�������ü������ԭ���������֪��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867kJ/mol
��CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��_________________________________��
��3����������ClO2���������������Ⱦ����Ӧ�������������ַ�Ӧ�����������ȥ����

��ӦI�IJ����л�������ǿ�����ɣ�������һ��ǿ��Ϊ���ᣬ��������NO2���ʵ�����ȣ���ѧ��Ӧ����ʽΪ______����Ӧ��������22.4L N2(��״��)��������ClO2______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪ![]() ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ��
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ��
t/��C | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
�����й���������ȷ����
A.�÷�Ӧ�Ļ�ѧ����ʽ��CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
B.������Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C.��ƽ��Ũ�ȷ������й�ϵʽ��![]() �����ʱ���¶�Ϊ1 000 ��C
�����ʱ���¶�Ϊ1 000 ��C
D.��1L���ܱ�������ͨ��CO2��H2��1mol��5 min���¶����ߵ�830��C����ʱ���COΪ0.4 mol����÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��̽�������ڷ�Һ����Ԫ�صļ�̬�����ⶨ�ò����ڷ�Һ����Ԫ�صĺ����Ƿ��ꡣ
![]()
(1)ʵ��һ��̽�������ڷ�Һ����Ԫ�صļ�̬��
��ͬѧ��ȡ1 mL�����ڷ�Һ������K3[Fe(CN)6]�����軯�أ���Һ��������ɫ������֤���ò����ڷ�Һ����Ԫ����Fe2+��ʽ���ڡ�
��ͬѧ��ȡ5 mL�����ڷ�Һ������10��KSCN��Һ�������ٵ���10��˫��ˮ��δ������ɫ����ͬѧΪ����û�г��ֺ�ɫʵ�������ԭ��������Һƽ����Ϊ3�ݽ���̽����
ԭ�� | ʵ����������� | ���� | ||
1 | ����ԭ��Ӱ�� | ��ͬѧ�۲�ò����ڷ�Һ�����ϱ�������������ά����C��ά����C�л�ԭ�ԣ��������Ǣ�______ | ȡ��1����Һ����������������˫��ˮ����δ����ɫ���� | �ų���_________Ӱ�� |
2 | ����ԭ�� | ���Ӣ�________��Һ��д��ѧʽ��̫�٣�����û�дﵽ��ӦŨ�� | ȡ��2����Һ�������μӸ���Һ����������Ȼδ���ֺ�ɫ | ˵�����Ǹ���Һ���ٵ�Ӱ�� |
3 | ������ʽ | ���ļ�̬��+3�ۣ������ܲ�������������Fe3+��ʽ���� | ȡ��3����Һ���μ�1��ϡ���ᣬ��ҺѸ�ٱ�Ϊ��ɫ | ˵��Fe3+�Ԣ�_______��ʽ���ڣ��û�ѧ����ʽ������֣�˵�������Ѹ���Ժ�ɫ��ԭ�� |
(2)��ͬѧע���ͬѧ��ϡ����������Һ������һ��ʱ�����ɫ�ֱ�dz�ˣ���������SCN-�и�Ԫ�صĻ��ϼۣ�Ȼ��dz�����Һ��Ϊ���ȷݣ�һ���е���KSCN��Һ�����ֺ�ɫ�ֱ����һ�ݵ���˫��ˮ�����ֺ�ɫ��ø�dz����������Ҳ�̼�����ζ���������ɡ�����ʵ�����������ӷ���ʽ��ʾ���ú���Һ��ɫ��dz��ԭ��________��
(3)ʵ��������������ڷ�Һ����Ԫ�صĺ����Ƿ��ꡣ
�ò����ڷ�Һ��ǩע������Ʒ����������(FeSO4��7H2O)ӦΪ375��425(mg/100 mL)����ʵ��С���������ʵ�飬�ⶨ������Ԫ�صĺ�������˵������ʵ����ά����C��Ӱ�����ų�������Ҫ����ά����C���ĵ�����KMnO4��Һ��
��ȡ�ò����ڷ�Һ100 mL���ֳ��ĵȷݣ��ֱ������ƿ�У����ֱ��������ϡ������
���� ________ʽ�ζ����м���0.002 mol.L-l����KMnO4��Һ������¼��ʼ�����
�۵ζ���ֱ����Һǡ��_____________��30���ڲ���ɫ����¼ĩ�����
���ظ�ʵ�顣�������ݼ��㣬ƽ����������KMnO4��Һ�����Ϊ35.00 mL������ÿ100 mL�ò����ڷ�Һ�к���Ԫ��__________mg����FeSO4��7H2O���������㣩���жϸò����ڷ�Һ����Ԫ�غ���___________����ϸ��ϸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£�����ѡ������ʾ�����ʼ�ת������һ��ʵ�ֵ���
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2 ![]() Cu(OH)2
Cu(OH)2 ![]() Cu
Cu
C.Al ![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
D.MgO(s)![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������й�������ȷ����
A. ��0.1 mol��L1 Na2CO3��Һ��ͨ������CO2�����c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. �����£�pH=6��NaHSO3��Һ�У�c(![]() )c(H2SO3)=9.9��107 mol��L1
)c(H2SO3)=9.9��107 mol��L1
C. �����ʵ���Ũ�ȡ��������Na2CO3��NaHCO3��ϣ�![]() <
<![]()
D. 0.1 mol��L1 Na2C2O4��Һ��0.1 mol��L1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ����ʽΪC4H8�л���������4��C��C����
B. ![]() ��
��![]() ���Ƿ�������
���Ƿ�������![]() ���Ƿ��������Ƿ��㻯����
���Ƿ��������Ƿ��㻯����
C. ![]() ��
��![]() ����������һ����CH2���������ͬϵ���ϵ
����������һ����CH2���������ͬϵ���ϵ
D. ����ʽΪC2H6O�ĺ������ͼ�Ϸ�����C��H����C��O���������գ��ɴ˿��Գ����Ʋ��л���ṹ��ʽΪC2H5��OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��1molH-H��,1molN-H��,1mol![]() ���ֱ���Ҫ��������436kJ��391kJ��946kJ,��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ________��
���ֱ���Ҫ��������436kJ��391kJ��946kJ,��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ________��
��2����2A+B![]() 2C+D��Ӧ��,��ʾ�÷�Ӧ������_____(��д��ĸ���)��
2C+D��Ӧ��,��ʾ�÷�Ӧ������_____(��д��ĸ���)��
a. v(A)=0.8molL-1s-1
b. v(B)=0.3molL-1s-1
c. v(C)=0.6molL-1s-1
d.v(D)=0.5molL-1s-1
��3��90��ʱ,amolL-1һԪ��HA��bmolL-1NaOH��Һ�������Ϻ�,���Һ��pHΪ7,����Һ���������ӵ�Ũ���ɴ�С��˳����________��
��4������ͼ�У����ձ���ʢ��100 mL 0.50 molL��1 AgNO3��Һ�����ձ���ʢ��100 mL 0.25 molL��1 CuCl2��Һ��A��B��C��D��Ϊ������ͬ��ʯī�缫��������һ��ʱ�����A����C����0.19 g�����ԴEΪ________����A���ĵ缫��ӦʽΪ_______��D����������________ mL(��״��)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ�һ���˼��������о������N4���ӡ�N4���ӽṹ��ͼ��ʾ����֪����1 mol N��N����167 kJ�������γ�1 mol ![]() �ų�942 kJ��������N2(g)��3H2(g)
�ų�942 kJ��������N2(g)��3H2(g)![]() 2NH3(g) ��H1����92 kJ/mol��N4(g)��6H2(g)
2NH3(g) ��H1����92 kJ/mol��N4(g)��6H2(g)![]() 4NH3(g) ��H2(kJ/mol)����������Ϣ�����ݣ�����˵����ȷ����(����)
4NH3(g) ��H2(kJ/mol)����������Ϣ�����ݣ�����˵����ȷ����(����)
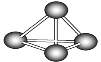
A.��H2��0B.N2���ӱ�N4�����ȶ�
C.��H2��2��H1D.��H2�뷽��ʽϵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com