
(12��)��һ���¶��£���a���ᣬb���ᣬc���������ᣮ����a��b��c��գ�
��1���������ʵ���Ũ����ͬʱ��c��H+���ɴ�С��˳����__________��
��2��ͬ�����ͬ���ʵ���Ũ�ȵ������ᣬ�к�NaOH�������ɴ�С��˳����__________��
��3��������c��H+����ͬʱ�����ʵ���Ũ���ɴ�С��˳��Ϊ__________��
��4��������c��H+����ͬ�����Ҳ��ͬʱ���ֱ����������п����ͬ״���²������������ɴ�С��˳����__________��
��5����c��H+����ͬ�������ͬʱ��ͬʱ������״���ܶȡ�������ȫ��ͬ��п����������ͬ�����H2����ͬ״��������Ӧ����ʱ��ij��̹�ϵ��__________��
��6����c��H+����ͬ�����������ˮϡ����ԭ����100����c��H+���ɴ�С��˳����__________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�����ѧ��11���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A��̼��������Һ�м������� CO32- + 2H+ =CO2�� + H2O
B�������������ᷴӦ S2- + 2H+ = H2S��
C�����������ڴ�����Һ C6H5O- + CH3COOH �� C6H5OH + CH3COO-
D���Ȼ�������Һ��ͨ���������� Fe2+ + Cl2 = Fe3+ + 2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�к���NH4+��SO32-��SiO32-��Br- CO32-��Na+�������Һ��ͨ�������Cl2�������ж���ȷ����
�ٷ�Ӧǰ����Һ������Ũ�Ȼ������ֲ����������
���н�״��������
���д̼�����ζ�������
����Һ��ɫ�����仯
����Һ�����ٷ�����3��������ԭ��Ӧ
A���٢ڢۢ� B���٢ڢۢܢ�
C���٢ۢܢ� D���ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�����ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ����Һ�У���������Ũ�ȵ�˵����ȷ����
A��һ��Ũ�ȵİ�ˮ��ˮϡ�͵Ĺ����У�c��NH4+��/ c��NH3��H2O���ı�ֵ��С
B��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ�У�
c��CO32���� > c��HCO3��������2c��Na+��=3c��H2CO3��+3c��HCO3-��+3c��CO32-��
C��������0.4mol/LHB��Һ��0.2mol/LNaOH��Һ�������Ϻ���Һ��pH=3������Һ����Ũ�ȴ��������ϵ�� c��B-��>c��Na+��>c��HB��>c��H+��>c��OH-��
D������HClO�ĵ���ƽ�ⳣ��ΪKa ��̼��ĵ��볣���ֱ��Ϊ��Ka1 ��Ka2����֪��Ka1 > Ka > Ka2 �� ������Ӧ��2NaClO + CO2��������+H2O=Na2CO3+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡӢ���и�����ѧ�ڵڶ����¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
����������������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧ��װ��ʾ��ͼ���й��������£�

ʵ�鲽�裺
��A�м���4.4g���촼��6.0g�����ᡢ����Ũ�����2��3Ƭ���Ƭ����ʼ��������A������50min����ӦҺ�������º����Һ©���У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ��ֳ��IJ������������ˮMgSO4���壬����Ƭ�̣����˳�ȥMgSO4���壬�����������ռ�140��143����֣�����������֬3.9 g.
�ش���������:
��1������B��������
��2����ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���� �ڶ���ˮϴ����ҪĿ����
��3����ϴ�ӡ���Һ������ ��Ӧ�����Ȼ���ã����ִӺ�(���š� .
��Ӧ�����Ȼ���ã����ִӺ�(���š� .
a��ֱ�ӽ���������֬�ӷ�Һ©�����Ͽڵ���
b��ֱ�ӽ���������ӷ�Һ�˶����¿ڷų�
c���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ���������֬���¿ڷų�
d���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ���������Ӵ��Ͽڵ���
��4����ʵ���м�����������Ŀ����
��5��ʵ���м���������ˮMgSO4��Ŀ����
��6������������У�����ѡ��װ����ȷ����_ (����)��

��7����ʵ��IJ�����_ (����).
a. 30 �� b. 40 �� c��60�� d��90��
30 �� b. 40 �� c��60�� d��90��
��8���ڽ����������ʱ:����130��㿪ʼ�ռ���֣���ʹʵ��IJ���ƫ (��ߡ��͡�������ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��12�֣���Դ�ۺ����üȷ�����ɫ��ѧ���Ҳ�Ǿ��ÿɳ�����չ����Ч;����һ�����ܵķ���������±ʯ������Ҫ�ɷֿɱ�ʾΪ��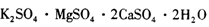 ����֪����ˮ��Һ�д�������ƽ�⣺
����֪����ˮ��Һ�д�������ƽ�⣺

Ϊ�˳�����ü���Դ��һ���ܽ���±ʯ�Ʊ�K2S04�����������£�

��1��������������
��2���û�ѧƽ���ƶ�ԭ������:Ca(OH)2��Һ���ܽ����±ʯ��Kʮ��ԭ��
��3�������ʻ��ڣ�Ϊ�˳�ȥCa2�������ȼ��� ��Һ��������Ȳ������ˣ�������Һ�еμ�ϡH2 S04��������ҺpH�� ��������ԡ��������ԡ����ԡ���
��4�������ڵIJ����������������̣����� �����ˡ�ϴ�ӡ����
��5�������ÿ�����̼����Ϊ�ܽ����������ԭ���ɱ�ʾΪ��

�����¸÷�Ӧ��ƽ�ⳣ��K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������и�����ѧ�����в������ۻ�ѧ�Ծ��������棩 ���ͣ������
��ˮ�Ǿ����Դ���⣬���ú�ˮ��ȡʳ�εĹ�����ͼ��ʾ���ش��������⣺

��1���ٴ����к���Ca2+��Mg2+��SO42-�����ʣ�����ʱ�����Լ�Ϊ��
A.���� B.BaCl2��Һ C.NaOH��Һ D.Na2CO3.��Һ��
�����Լ���˳���� ______��
�ڵ�ⱥ��ʳ��ˮʱ�����Դ���������ĵ缫�Ϸ����ķ�ӦΪ ______�����Դ���������ĵ缫������ҺpH�ı仯�� ��
��2����ҵ�ϴӺ�ˮ����ȡ��NaCl����������ȡ������Ҫ�������£���ʳ��ˮ����ͨ������A����ͨ������B����ַ�Ӧ����˵õ�����C����ҺD��������C���ռ����Ƶô��������B�� (�ѧʽ)����NaCl��ȡ���Ӧ�Ļ�ѧ����Ϊ_______ ��______ ___��
��3����ˮ��þ��һ�ι���������ͼ��

Ũ��ˮ����Ҫ�ɷ����£�
���� | Na+ | Mg2+ | Cl- | SO42- |
Ũ��/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
�ù��չ����У��������Ҫ��Ӧ�����ӷ���ʽΪ ______��1 LŨ��ˮ���ɵõ���Ʒ2�����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�°���У��������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�����������������ȷ����
A��1mol����-CH3������9NA������
B����״���£�22.4LSO3���е�ԭ����Ϊ4NA
C��0.10mol.L-1NaOH��Һ�к���OH-��������0.1NA
D��5.6g Fe��2.24LCl2��ַ�Ӧת�Ƶ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���³�ѹ�£���a mol CO2����ͨ��1L bmol/L��NaOH��Һ�У����ж�������Һ����������ȷ��
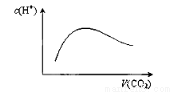
A����a��2bʱ������CO2�����ͨ�룬��Һ����ˮ�������c��H����������ͼ�仯��ϵ
B����a��bʱ��������Һ�д��ڣ�c��OH������c��CO32-����c��H������c��H2CO3��
C����2a��bʱ��������Һ�д��ڣ� c��Na������c��CO32-����c��OH������c��HCO3������c��H����
D����1/2��a/b��1ʱ��������Һ��һ�����ڣ� c��Na������c��CO32-����c��HCO3������c��H2CO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com