
【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A | B | C | D | |
甲 | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
乙 | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是( )
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时, 18O在所有物质中都存在
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂。已知NH4ClO4在400℃时开始分解。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量)。
(1)甲同学设计如图实验(部分夹持装置已省略):
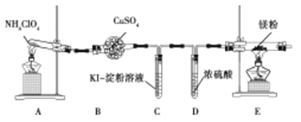
①若高氯酸铵分解有氯气生成,则可能观察到的现象是 ,写出产生该现象的离子方程式 。
②实验完毕后,取出E中硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使红色湿润的石蕊试纸变蓝色。R的电子式为 。硬质玻璃管中固体与水反应放出R的化学方程式为 。
(2)乙同学认为,A中可能产生O2。为了验证他的猜想,选择上述部分装置和下列提供的装置进行实验:
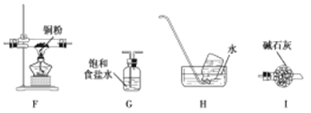
①按气流从左至右,装置的连接顺序为 。
②能说明有氧气的现象是 。
(3)通过查阅资料:NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,写出高氯酸铵分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
元素A、B、C、D、E、F、G在元素周期表中的位置如下图所示,回答下列问题:

(1)G的基态原子核外电子排布式为________。原子的第一电离能:D________E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l > l-b > b-b(l为孤对电子对,b为键合电子对),则关于A2C中的A-C-A键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于________晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为________。
(4)化合物BCF2的立体构型为________,其中B原子的杂化轨道类型是________,写出两个与BCF2具有相同空间构型的含氧酸根离子________。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。每个晶胞中含有___________个E2+,列式计算EC晶体的密度(g·cm-3)______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等八种物质存在如下转化关系(反应条件、部分产物未标出)。已知:A为正盐,B是能使品红溶液褪色的气体,E是碱性气体,G是红棕色气体。按要求回答问题:
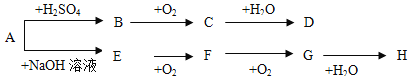
(1)写出下列物质的化学式:B ,D ,E ,F 。
(2)设计实验检验A溶液中的阳离子,写出实验操作、现象和结论 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
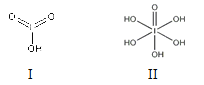
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
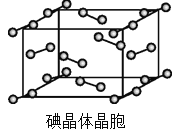
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
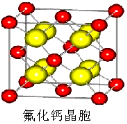
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
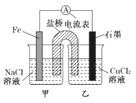
A.原电池的总反应为 Fe+Cu2+=Fe2++Cu
B.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D.盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物中一个碳原子上连有两个羟基时,易脱水形成碳氧双键;物质A~F有如下转化关系:

试回答下列问题:
(1)E中含有的官能团的名称是________,C跟新制的氢氧化铜悬浊液反应的化学方程式为________。
(2)A与NaOH溶液共热时反应的化学方程式为________。
(3)已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为________。
(4)F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应。若F苯环上的一氯代物只有两种,F在一定条件下发生加聚反应的化学方程式为________。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。则G可能有________种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃是
A. 2-甲基-1-丁炔 B. 2-甲基-3-丁炔 C. 3-甲基-1-丁炔 D. 3-甲基-2-丁炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com