
分析 (1)根据水分子是10电子微粒,自身作用生成阴阳离子的电子数相同分析;
(2)依据水电离出的氢离子浓度减小,说明水的电离被抑制,分析判断溶液是酸或碱,结合各组离子,能反应的不共存,酸碱中都不存在的一定不共存,酸或碱中只有一种存在的为肯共存;
(3)依据反应前后化合价的变化,结合氧化还原反应的实质分析水的作用.
解答 解:(1)依据水分子自身作用生成含有相同电子数的阴、阳两种离子,可知水分子是10电子分子,失去氢离子后剩余氢氧根离子为10电子微粒,水分子结合氢离子仍为10电子微粒,所以此过程的方程式为,2H2O?H3 O++OH-;
故答案为:2H2O?H3 O++OH-;
(2)25℃时,在由水电离产生的c(H+)=1×10-14 mol•L-1的溶液中,水的电离被抑制,所以溶液是酸或碱;
①NH4+、Al3+、Br-、SO42-,酸中共存,碱中NH4+、Al3+不共存; ②Na+、Mg2+、Cl-、NO3-酸中共存,碱中Mg2+不共存;③K+、Ba2+、Cl-、NO3- 酸碱中都可以共存;④K+、Na+、HCO3-、SO42-
HCO3-酸碱中都不共存;所以一定可以大量共存的是③;可能大量共存的是①②;一定不能大量共存的是④;
故答案为:③;①②;④
(3)A.Cl2+H2O=HCl+HClO 依据化合价变化,此反应是氯气的自身氧化还原反应,水既不是氧化剂也不是还原剂;
B.2Na2O2+2H2O=4NaOH+O2↑据化合价变化,此反应是过氧化钠的自身氧化还原反应,水既不是氧化剂也不是还原剂
C.CaH2+2H2O=Ca(OH)2+2H2↑依据化合价变化,水中的氢元素化合价升高,水做氧化剂;
D.3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.依据化合价的变化,水中的氢元素化合价升高,水做氧化剂;
故答案为:CD;AB.
点评 本题考查了水的电离、离子反应、氧化还原反应,题目难度中等,明确离子反应和离子共存的判断方法以及氧化还原反应中的概念是解题的关键,侧重于考查学生的分析能力和应用能力.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应是分解反应 | B. | 反应中氮元素的化合价降低 | ||
| C. | 氧化剂是N2O4 | D. | 该反应不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③均是氧化还原反应 | |
| B. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| C. | 氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3 | |
| D. | 反应③中0.1mol还原剂共失去电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
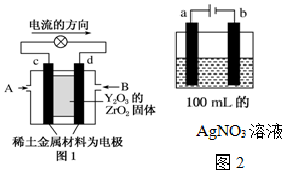 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++OH -=H2O | |
| B. | Cl -+Ag+=AgCl↓ | |
| C. | Cu 2++2OH -+Ba 2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| D. | H++SO42-+OH-+Ba 2+=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
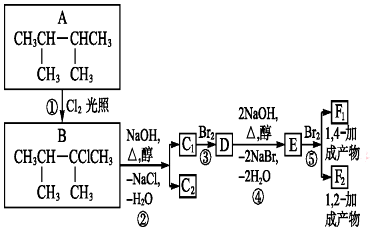
 .
. ;F1的结构简式是
;F1的结构简式是 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com