
| A. | 24 | B. | 42 | C. | 66 | D. | 108 |
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
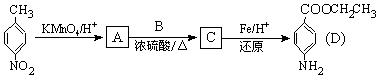
 、BCH3CH2OH、C
、BCH3CH2OH、C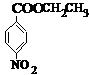 .
.
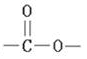
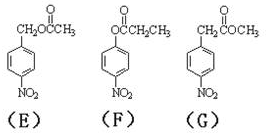
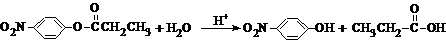 .
.

 的流程图(无机试剂任选).合成路线流程图示如图:
的流程图(无机试剂任选).合成路线流程图示如图:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银白色金属 | B. | 不与氧气反应 | ||
| C. | 能发生铝热反应 | D. | 能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| B. | 碳酸氢钠溶液中加盐酸 CO32-+2H+═CO2和H2O | |
| C. | 氢氧化钠溶液中加硫酸镁 2OH-+Mg2+═Mg(OH)2 | |
| D. | 氢氧化钡溶液中加硫酸 OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com