
| A. | 苯、溴苯 | B. | 正丁烷和异丁烷 | C. | 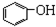 和 和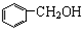 | D. | 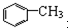 和 和 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,以此解答该题.
解答 解:A、苯和溴苯的官能团不同,即结构不相似,故不是同系物,故A错误;
B、正丁烷和异丁烷均为烷烃,故结构相似,但在分子组成上不相差1个CH2原子团,故不为同系物,互为同分异构体,故B错误;
C、 属于酚类,而
属于酚类,而 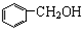 属于醇类,故结构不相似,故C错误;
属于醇类,故结构不相似,故C错误;
D、 和
和 的结构中均只含一个苯环,且侧链均为烷烃基,故结构相似,且在分子组成上相差1个CH2原子团,故互为同系物,故D正确.
的结构中均只含一个苯环,且侧链均为烷烃基,故结构相似,且在分子组成上相差1个CH2原子团,故互为同系物,故D正确.
故选D.
点评 本题考查了同系物的判断,为高频考点,侧重于双基的考查,题目难度不大,有利于培养学生良好的科学素养,注重概念的理解和运用.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
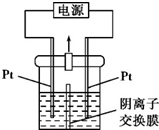 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.
“摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和味精 | B. | 味精和糖 | C. | 铁粉和硅胶 | D. | 铁粉和碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
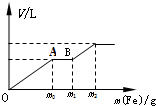 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用作半导体材料 | |
| B. | 二氧化硅可用于制造光导纤维 | |
| C. | Fe2O3 俗称铁红,常用作红色油漆和涂料 | |
| D. | 煤是一种清洁能源,直接燃烧不会造成环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com