
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中 ,溶液内发生反应的离子方程式,其中不正确的是
,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
科目:高中化学 来源: 题型:
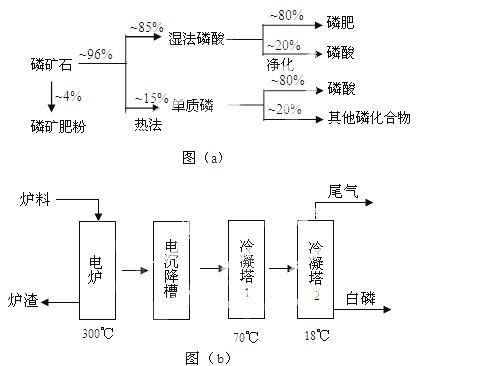
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca5(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:  。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品
。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品 磷酸 吨。
磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾 气先通入纯碱溶液,
气先通入纯碱溶液, 可除去
可除去 
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知原子序数依次递增的5种非金属元素,A的原子半径在所有原子中最小,B元素组成的化合物种类最多,C的最外层电子数是内层电子数的3倍,且与B同周期,D与B同主族,E在C的下一周期,且是同周期元素中非金属性最强的元素。
回答下列问题:
(1)由A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2 ②BA4 ③A2C2 ④BE4,其中属于极性分子的是________(填序号)。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是_______________。
(3)B、C两元素都能和A元素组成两种常见的溶剂,其分子式为________、________。DE4在前者中的溶解性________(填“大于”或“小于”)在后者中的溶解性。
(4)BA4、BE4和DE4的沸点从高到低的顺序为_________________(填化学式)。
(5)A、C、E三种元素可形成多种含氧酸,如AEC、AEC2、AEC3、AEC4等,以上列举的四种酸其酸性由强到弱的顺序为______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中 重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
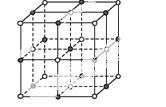
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填序号)。
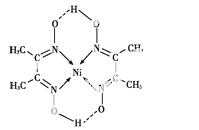
A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是_______ _(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
_(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶 液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是
液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是
A.原溶液中c(Br-)=0.4mol/L B.反应后溶液中c(Fe3+)=c(Fe2+)
C.反应后溶液中c(Fe3+)=0.1mol/L D.原溶液的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积 相等时密度相等 B.原子数相等时具有的中子数相等
相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-⑤可能含有NH4+ ( )
A.①③⑤ B.①②③ C.③④⑤ D. ②③④
②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com