
| A£®Ć÷·Æ¾»Ė®µÄŌĄķŹĒAl3+Ė®½ā²śÉśAl(OH)3½ŗĢ壬Al(OH)3½ŗĢåÄÜĪüø½Ė®ÖŠµÄŠüø”ŌÓÖŹ£¬²¢Ź¹Ö®³Į½µ |
| B£®Ä¦¶ūŃĪµÄÖʱøŌĄķĪŖ£ŗ6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O£¬·“Ó¦Ö®ĖłŅŌÄܽųŠŠµÄŌŅņŹĒ(NH4)2Fe(SO4)?6H2OČܽā¶Č×īŠ” |
| C£®¶ĘŠæĢśĘ¤ŌŚĖįÖŠČܽā£¬µ±¶Ę²ć·“Ó¦ĶźČ«Ź±£¬²śÉśĒāĘųµÄĖŁĀŹ»įĶ»Č»¼õĀż |
| D£®½«»š²ńĶ·Ö±½Ó½žČėĘ·ŗģČÜŅŗÖŠ£¬æÉŅŌ¼ģŃ黚²ńĶ·ÖŠŹĒ·ńŗ¬ÓŠĮņŌŖĖŲ |
 Al(OH)3£«3H£« ,Al(OH)3½ŗĢåÄÜĪüø½Ė®ÖŠµÄŠüø”ŌÓÖŹ£¬²¢Ź¹Ö®³Į½µ
Al(OH)3£«3H£« ,Al(OH)3½ŗĢåÄÜĪüø½Ė®ÖŠµÄŠüø”ŌÓÖŹ£¬²¢Ź¹Ö®³Į½µ

 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

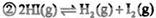
| A£®9 | B£®16 | C£®20 | D£®25 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CH3OH(g)£«H2O(g) ”£
CH3OH(g)£«H2O(g) ”£
 CH3OH (g) ¦¤H£½£90.8 kJ”¤mol-1
CH3OH (g) ¦¤H£½£90.8 kJ”¤mol-1 CH3OCH3(g)£«H2O(g) ¦¤H£½£23.5 kJ”¤mol-1
CH3OCH3(g)£«H2O(g) ¦¤H£½£23.5 kJ”¤mol-1 CO2 (g)£«H2(g) ¦¤H£½£41.3 kJ”¤mol-1
CO2 (g)£«H2(g) ¦¤H£½£41.3 kJ”¤mol-1| A£®øßĪĀøßŃ¹ |
| B£®¼ÓČė“߻ƼĮ |
| C£®¼õÉŁCO2µÄÅØ¶Č |
| D£®Ōö¼ÓCOµÄÅضČE£®·ÖĄė³ö¶ž¼×ĆŃ |
 CH3OCH3(g)£«H2O(g)ŌŚÄ³ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK = 400”£“ĖĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČėCH3OH£¬·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ
CH3OCH3(g)£«H2O(g)ŌŚÄ³ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK = 400”£“ĖĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČėCH3OH£¬·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ| ĪļÖŹ | CH3OH | CH3OCH3 | H2O |
| c / mol”¤L-1 | 0.44 | 0.60 | 0.60 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2SO3£Øg£© ¦¤H£½£196.6 kJ”¤mol-1
2SO3£Øg£© ¦¤H£½£196.6 kJ”¤mol-1 2NO2£Øg£© ¦¤H£½£113.0 kJ”¤mol-1
2NO2£Øg£© ¦¤H£½£113.0 kJ”¤mol-1 SO3£Øg£©+NO£Øg£©µÄ¦¤H£½ kJ”¤mol-1”£
SO3£Øg£©+NO£Øg£©µÄ¦¤H£½ kJ”¤mol-1”£ CH3OH£Øg£©”£
CH3OH£Øg£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

A£®µē½āĖ®ÖĘĒā£ŗ2H2O 2H2”ü£«O2”ü 2H2”ü£«O2”ü |
B£®øßĪĀŹ¹Ė®·Ö½āÖĘĒā£ŗ2H2O 2H2”ü£«O2”ü 2H2”ü£«O2”ü |
C£®Ģ«Ńō¹ā“߻ƷֽāĖ®ÖĘĒā£ŗ2H2O 2H2”ü£«O2”ü 2H2”ü£«O2”ü |
D£®ĢģČ»ĘųÖĘĒā£ŗCH4£«H2O CO£«3H2 CO£«3H2 |
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®KWĖęČÜŅŗĪĀ¶Č”¢ÅØ¶ČµÄøıä¶ųøıä |
| B£®·²ŹĒŃõ»Æ»¹Ō·“Ó¦£¬¶¼ŹĒ·ÅČČ·“Ó¦ |
| C£®¶ŌŅŃ“ļµ½»ÆŃ§Ę½ŗāµÄ·“Ó¦£¬øıäŃ¹Ēæ£¬Ę½ŗāŅ»¶Øøıä |
| D£®Čõµē½āÖŹµÄµēĄė³Ģ¶Č£¬ÓėĪĀ¶Č”¢ÅØ¶Č¾łÓŠ¹ŲĻµ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
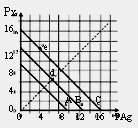
|
| A£®AĻߏĒAgCl£¬CĻߏĒAgI | B£®eµć±ķŹ¾ÓɹżĮæµÄKIÓėAgNO3·“Ó¦²śÉśAgI³Įµķ |
| C£®dµćŹĒŌŚĖ®ÖŠ¼ÓČė×ćĮæµÄAgBrŠĪ³ÉµÄ±„ŗĶČÜŅŗ | |
| D£®BĻßŅ»¶ØŹĒAgBr |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ·“Ó¦ĖŁĀŹĄķĀŪŹĒŃŠ¾æŌõŃłŌŚŅ»¶ØŹ±¼äÄŚæģ³ö²śĘ· |
| B£®»ÆŃ§Ę½ŗāĄķĀŪŹĒŃŠ¾æŌõŃłŹ¹ÓĆÓŠĻŽŌĮĻ¶ą³ö²śĘ· |
| C£®»Æѧ·“Ó¦ĖŁĀŹĄķĀŪŹĒŃŠ¾æŌõŃłĢįøßŌĮĻ×Ŗ»ÆĀŹ |
| D£®»ÆŃ§Ę½ŗāĄķĀŪŹĒŃŠ¾æŌõŃłŹ¹ŌĮĻ¾”æÉÄܶąµŲ×Ŗ»ÆĪŖ²śĘ· |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com