
【题目】按要求填空
(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
【答案】 ![]()
![]() 2,4-二甲基-3-乙基-3-己烯 1,4-二甲苯 (CH3)3CC(CH3)3 2,2,3,3-四甲基丁烷
2,4-二甲基-3-乙基-3-己烯 1,4-二甲苯 (CH3)3CC(CH3)3 2,2,3,3-四甲基丁烷 ![]() 或
或![]()
【解析】(1)羟基和乙烯的电子式分别是![]() 、
、![]() 。(2)①分子中含有1个碳碳双键,主链含有6个碳原子,名称是2,4-二甲基-3-乙基-3-己烯;②属于苯的同系物,名称是1,4-二甲苯;(3)114÷14=8……2,因此是庚烷,其一氯代物只有一种,说明该有机物分子中的氢原子位置只有1种,满足该条件的结构简式为(CH3)3CC(CH3)3,该物质的名称为2,2,3,3-四甲基丁烷;(4)某烃1分子含有50个电子.该烃只能由一种结构的炔烃加氢得到,该有机物可能为烷烃或烯烃,通式为:CnH2n或CnH2n+2,分子中含有的电子为:①6n+2n=50或②6n+2n+2=50,根据①可得:n=25/4(舍弃),根据②可得:n=6,所以该有机物为烷烃,分子式为:C6H14,该戊烷只能由一种结构的炔烃加氢获得,即:向该烷烃的碳架中添加碳碳三键,只有一种添法,满足条件的烷烃的结构简式为:CH3CH2C(CH3)3或CH3CH2CH(CH3)CH2CH3,改写成键线式为
。(2)①分子中含有1个碳碳双键,主链含有6个碳原子,名称是2,4-二甲基-3-乙基-3-己烯;②属于苯的同系物,名称是1,4-二甲苯;(3)114÷14=8……2,因此是庚烷,其一氯代物只有一种,说明该有机物分子中的氢原子位置只有1种,满足该条件的结构简式为(CH3)3CC(CH3)3,该物质的名称为2,2,3,3-四甲基丁烷;(4)某烃1分子含有50个电子.该烃只能由一种结构的炔烃加氢得到,该有机物可能为烷烃或烯烃,通式为:CnH2n或CnH2n+2,分子中含有的电子为:①6n+2n=50或②6n+2n+2=50,根据①可得:n=25/4(舍弃),根据②可得:n=6,所以该有机物为烷烃,分子式为:C6H14,该戊烷只能由一种结构的炔烃加氢获得,即:向该烷烃的碳架中添加碳碳三键,只有一种添法,满足条件的烷烃的结构简式为:CH3CH2C(CH3)3或CH3CH2CH(CH3)CH2CH3,改写成键线式为![]() 或
或![]() 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如图,下列说法中正确的是
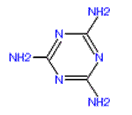
A. 该物质可用作食品添加剂
B. 三聚氰胺属于有机高分子化合物
C. 分子中所有原子都在同一平面上
D. 三聚氰胺含氮量很高,能冒充蛋白质通过检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知:
①RX +Mg![]() R-MgX(格氏试剂);
R-MgX(格氏试剂);
②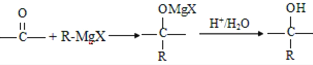
阅读以下合成路线图,回答有关问题:
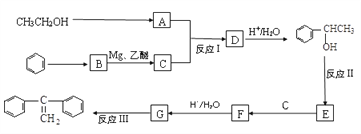
(1)反应I的类型是_____________,反应II的条件是___________________ 。
(2)反应III的化学方程式为____________________________________ 。
(3)E的同分异构体中,含有苯环且能发生银镜反应的有机物共有____种。
(4)有机物 ![]() 是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
是合成药物中的一种原料,实验室可用下列合成路线合成该有机物: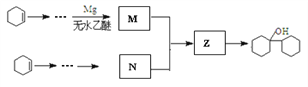
其中Z的结构简式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
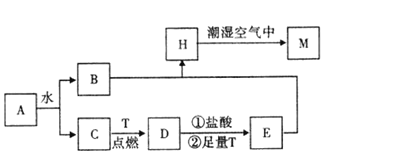
(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是______________________________________,化学方程式为___________________________________________。
(3)A和水反应生成B和C的离子方程式为___________________________________,由此反应可知A有作为_________的用途。
(4)步骤①的离子方程式_______________________________________,请写出检验步骤①得到的溶液中主要阳离子(除H+外)所需要的试剂:_____________、____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B. 若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C. 铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有X-、Y2-、Z2-三种常见的无机离子。如下图所示,发生了一系列化学反应。第④步反应生成的白色沉淀中含Y2-.

(1)判断X-、Y2-、Z2-分别为________、________、________(写离子符号)。
(2)写出④、⑤步反应的离子方程式。
④______________________________________________________;
⑤______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca5(PO4)3OH![]() 5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
A. 少吃甜食 B. 多喝碳酸饮料
C. 在牙膏中加入氟化物添加剂 D. 在牙膏中添加适量的Ca2+或PO43-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的催化氧化: ![]() ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
容器温度 物质的量(mol) |
400℃ |
425℃ |
450℃ |
475℃ |
500℃ |
O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内![]() 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时, ![]() 容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
(3)在右图中画出![]() 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________

(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com