
����Ŀ��I. Ϊ�Ƚ�Cl2��Fe3+��SO2�������ԣ�����ͼ��ʾװ�ý���ʵ�飬��������£�

��.���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��.����a���μ�һ������Ũ���ᣬ��A���ȡ�
��.��B�е���Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��.����b��ʹԼ2mL����Һ����D�Թ��У��������е����ӡ�
��.���ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
��.�����Թ�D���ظ����̢ܣ�����B��Һ�е����ӡ�
��1�����н������ҺΪ__________��
��2����A�������������36.5%�ܶ�Ϊ1.2g/mL����100mLʱ���䷴Ӧת�Ƶĵ�����ĿΪ______��
��3�����̢��м���B��Һ���Ƿ�����������ӵIJ�����___________��
��4���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤�������Ե���____ͬѧ����������˳��Ϊ____________��
���̢� B��Һ�к��е����� | ���̢� B��Һ �к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
II. NaNO2����Ҫ�ķ�������+3�۵ĵ�����������Ӧ�������Ի����в��ȶ�����5mol/Lˮ��ҺpHΪ9��ij��ѧ��ȤС���������ͼ��ʾװ���Ʊ��������ơ�������Ǣٹرյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ���һ��ʱ���ֹͣ���ȡ��ش��������⣺

��1��B�й۲����Ҫ������__________��Dװ�õ�������____________��
��2������C�в������������ƵIJ�����_______����Ӧ��Ӧ����ʽΪ___________��
��3��������C�в����������ƺ������١�a. ��ͬѧ��ΪC�в��ﲻ�����������ƣ������������ʡ�Ϊ�ų����ţ�����B��Cװ�ü�����װ��E��E��ʢ�ŵ��Լ���_______��д���ƣ���b. ��ͬѧ��Ϊ���������������⣬�������������뷴Ӧ���²�Ʒ������������ʵ�������ǰӦ����һ���������ò�����___��
��4���������������HNO2��Ka��ֵΪ______________��
���𰸡� NaOH��Һ С��0.6NA ���������ữ���Ȼ�����Һ���۲��Ƿ��а�ɫ�������������У���˵��������������ӣ���֮���� �ҡ��� Cl2��Fe3+��SO2 ��Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð�� ��ȥδ��Ӧ��NO����ֹ��Ⱦ���� ����I���������������Թ��У�����ϡ���ᣬ��������ɫ���岢��Һ���Ϸ���Ϊ����ɫ����C�в������������� 3NO2��+2H+=NO3��+2NO��+H2O
����II���������������Թ��У���������KMnO4��Һ������Һ��ɫ��ȥ����C�в������������� 5NO2��+2MnO4��+6H+=5NO3��+2Mn2++3H2O ��ʯ�� ���ɼУ�ͨ��N2һ��ʱ�� 5��10��4
��������I. ��1�������ж������н���NaOH��Һ������������������ֹ��Ⱦ���ʴ�Ϊ��NaOH��Һ��
��2��A�еķ�ӦΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��36.5%�ܶ�Ϊ1.2g/ml����100ml�к����Ȼ�������ʵ���Ϊ
MnCl2+Cl2��+2H2O��36.5%�ܶ�Ϊ1.2g/ml����100ml�к����Ȼ�������ʵ���Ϊ![]() ��0.1=1.2mol����Ӧһ��ʱ����ϡ���ᣬ��Ӧ���ٽ��У����ת�Ƶĵ���������0.6NA���ʴ�Ϊ������0.6NA��
��0.1=1.2mol����Ӧһ��ʱ����ϡ���ᣬ��Ӧ���ٽ��У����ת�Ƶĵ���������0.6NA���ʴ�Ϊ������0.6NA��
��3������������Һ�����ԣ��������������Ӧѡ��ϡ������Ȼ�����Һ������Ϊ���������ữ���Ȼ�����Һ���۲��Ƿ��а�ɫ�������������У���˵��������������ӣ���֮�������ʴ�Ϊ�����������ữ���Ȼ�����Һ���۲��Ƿ��а�ɫ�������������У���˵��������������ӣ���֮������
��4�����е�һ����Fe3+����Fe2+���������������Դ��������ӣ��ڶ�������������ӣ������ǹ���������������������������֤�����������DZ����������������е�һ�Σ�˵���������㣬���������Դ��������ӣ��ڶ�������������ӣ�˵���������������������ӵķ�Ӧ���������������Ӵ��ڶ��������е�һ����Fe3+����Fe2+���������������Դ��������ӣ��ڶ������������ӣ�˵���������������������ӵķ�Ӧ���������������Ӵ��ڶ�������������˳��ΪCl2��Fe3+��SO2���ʴ�Ϊ���ҡ�����Cl2��Fe3+��SO2��
II. Aװ����C��Ũ���ᷢ��������ԭ��Ӧ����NO2����Ӧ����ʽΪC+4HNO3��Ũ��=CO2��+4NO2��+2H2O��NO2ͨ��B�к�ˮ������Ӧ3NO2+H2O=2HNO3+NO��Cu��ϡ���ᷢ����Ӧ3Cu+8HNO3=3CuNO3+2NO��+4H2O��C�з�����Ӧ 2NO+Na2O2=2NaNO2��ʣ���NO�����Ը��������Һ�����������ᡣ
��1����������������B�й۲����Ҫ��������Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð����NO�ж�����ֱ���ſգ�NO�����Ը��������Һ��Ӧ������������Ӻ������ӣ�Dװ�õ������dz�ȥNO����ֹ��Ⱦ�������ʴ�Ϊ����Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð������ȥδ��Ӧ��NO����ֹ��Ⱦ������
��2�����������ܺ�ϡ���ᷴӦ������ɫ����NO��NO���ȶ��ױ������������ɺ���ɫ���������������ʵ������˵�������������ƣ���صķ�Ӧ����ʽΪ3NO2��+2H+=NO3��+2NO��+H2O���ʴ�Ϊ���������������Թ��У�����ϡ���ᣬ��������ɫ���岢��Һ���Ϸ���Ϊ����ɫ����C�в������������ƣ�3NO2��+2H+=NO3��+2NO��+H2O��
��3����Bװ���г����������к���NO��������̼��ˮ�������⼸�����ʶ��ܺ������Ʒ�Ӧ��ҪʹC��ֻ��NO�������Ʒ�Ӧ����BCװ�ü��Eװ��Ӧ��������ˮ�����Ͷ�����̼��ʹ�õ�ҩƷ�Ǽ�ʯ�ң�Ҫ�ų�������ֹ������Ӧ��Ӧ����ͨ��һ��ʱ��ĵ������ʴ�Ϊ�����ɼУ�ͨ��N2һ��ʱ�䣬�ʴ�Ϊ����ʯ�ң����ɼУ�ͨ��N2һ��ʱ�䣻
��4��5mol/L NaNO2��Һ��pHΪ9��Kh=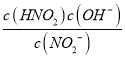 =
=![]() =
=![]() ��10-10=
��10-10=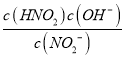 ��
��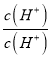 =
=![]() �� Ka=
�� Ka=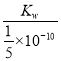 =5��10��4���ʴ�Ϊ��5��10��4��
=5��10��4���ʴ�Ϊ��5��10��4��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵����ȷ����
A. ��ϩ�ͱ�����ʹ��ˮ��ɫ����ɫ��ԭ����ͬ
B. ����ϩ�ɷ����ӳɷ�Ӧ
C. �Ҵ�������������������ñ���Na2CO3��Һ����
D. ���������ڸ߷��ӻ����һ�������¶���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ⱦ���Ż������ʾ�������Ҫ��
��1����CH4����ԭ�����������������������Ⱦ�����ķ�Ӧ���£�
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+4NO2(g)![]() 2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ/mol
����0.2molCH4��NO2��ԭΪN2�������������зų�������Ϊ________kJ��������ˮȫ������̬��ʽ���ڣ�
��2���û���̿�ɴ���������Ⱦ��NO����2L�ܱ������м���NO�ͻ���̿�������ʣ�����������E��F�����ڶȷֱ���T1��T2ʱ����÷�Ӧ�ﵽƽ��ʱ���������ʵ������±���

�������ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ_______________��
��T1�� ʱ��������Ӧ��ƽ�ⳣ����ֵΪ________�������֪T2��T1����÷�Ӧ����Ӧ�ġ�H___���>����<����=����0
�� ��T1�¶��·�Ӧ�ﵽƽ������д�ʩ��������NOת���ʵ���_______��
a�������¶� b������ѹǿ c.����c(NO) d����ȥ����F
��3������β�������еķ�Ӧ��2NO+2CO![]() 2CO2+N2��ij�¶�ʱ����1L�ܱ������г���0.1molCO��0.1mol NO��5sʱ��Ӧ�ﵽƽ�⣬���NO��Ũ��Ϊ0.02mol/L����Ӧ��ʼ��ƽ��ʱ��NO��ƽ����Ӧ����v(NO)=________�������¶��£�ijʱ�̲��CO��NO��N2��CO2��Ũ�ȷֱ�Ϊ0.01mol/L��amol/L��0.01mol/L��0.04mol/L��Ҫʹ��Ӧ������Ӧ������У�a��ȡֵ��ΧΪ_____________��
2CO2+N2��ij�¶�ʱ����1L�ܱ������г���0.1molCO��0.1mol NO��5sʱ��Ӧ�ﵽƽ�⣬���NO��Ũ��Ϊ0.02mol/L����Ӧ��ʼ��ƽ��ʱ��NO��ƽ����Ӧ����v(NO)=________�������¶��£�ijʱ�̲��CO��NO��N2��CO2��Ũ�ȷֱ�Ϊ0.01mol/L��amol/L��0.01mol/L��0.04mol/L��Ҫʹ��Ӧ������Ӧ������У�a��ȡֵ��ΧΪ_____________��
��4��ij������������ͼ��ʾװ�ã�̽��NO2��O2��������N2O5�γ�ԭ��صĹ��̡�����Y������Ϊ_______���õ�ص�������ӦʽӦΪ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����
��1��������ʳ������Ӫ�����⣬��������ѧ�������ɳ�����Ҫ��֤��
������������������Ӫ�����ʣ��������������շֽ�Ϊ�� ����
A�������� B�������� C��֬����
������������������ Aʳ�� Bʳ�� Cƻ��֭ D������ E��ù�أ��밴����Ҫ�����(�����)��
����ά����C���� ����ֱ�ӽ���ѪҺ�������������� ��Ӧ����㷺�Ŀ�����֮һ���� ��������Ϊ��ζ�����ֿ���Ϊ���������� ��ʳ�ù��������Ѫѹ���ߡ���������� ��
��2����������������ͷ�չ�����ʻ���������ʹ�ò��Ͽ��Ը������ǵ����
������װ����ʹ�������Ļ��ͷų�һ�ֻӷ������ʣ����ڽӴ������������Ƥ�ף����߹����쳣���ûӷ��������ǣ� ����
A���ƾ� B������ C����ȩ
��һ������£��Ͻ��������ijɷֽ���Ӳ�� (���С)��
�����������뵼��������� ���ѧʽ��������ʳƷ����Ĥ�ĵĸ߷��Ӳ��ϵĽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ұ����Խ��Խ�ܵ���ѧ�ҵ����ӣ�������Ĺؼ�֮һ��Ѱ��һЩ�����ø�������й������������(����)
A��ø��һ�ֵ�����
B��øֻ����ǿ���Ի������������²��ܷ�������
C��ø�Ĵ����и�Ч�ԡ�ѡ���Ժ�רһ��
D����չ����ұ���������ڽ�Լ��Դ�ͱ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л�Ϊͬϵ����� ����Ϊͬ���칹����� ����Ϊͬ����������� ������ͬλ�ص��� ����ͬһ�����ʵ���
��O2 ���ȷ� ��CH3CH2OH ��O3 ��CHCl3 ��CH3��O��CH3
��![]() C ��
C ��![]() ��
��![]() C ��CH3OH��
C ��CH3OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̷�����ѧ�仯���ǣ� ��
A.��ˮ�ӷ�
B.��ˮɹ��
C.�䡢Ũ����ʹ��Ƭ�ۻ�
D.�ɱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ)��Cr(OH)4(��ɫ)��Cr2O72(�Ⱥ�ɫ)��CrO42(��ɫ)����ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
��1��Cr3+��Al3+�Ļ�ѧ�������ơ���Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������_________��
��2��CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol![]() L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
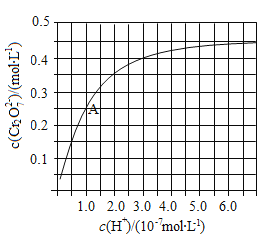
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ____________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����__________(�������С�����䡱)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__________��
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H______0(����ڡ���С�ڡ����ڡ�)��
��3���ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ��Cl������Ag+��CrO42����ש��ɫ������ָʾ����ζ��յ㡣����Һ��Clǡ�ó�����ȫ(Ũ�ȵ���1.0��105 mol��L1)ʱ����Һ��c(Ag+)Ϊ_______ mol![]() L1����ʱ��Һ��c(CrO42)����__________ mol
L1����ʱ��Һ��c(CrO42)����__________ mol![]() L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
��4��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72��ԭ��Cr3+���÷�Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com