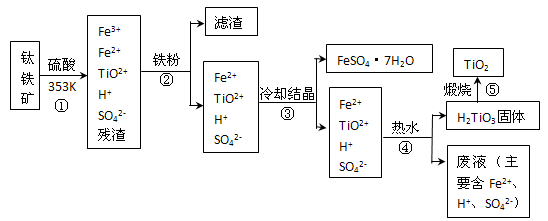
有X、Y、Z和W四种元素.已知:①X、Y、Z属同一短周期,其离子以X
2+、Y
3+、Z
-的形式存在.②W和Z组成化合物WZ
3溶液遇苯酚呈紫色.请回答:
(1)Z的最高价氧化物对应水化物的名称为
高氯酸
高氯酸
.
(2)X的单质在二氧化碳中燃烧的化学方程式为
.
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式
,Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因
在氢氧化铝中存在电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解
在氢氧化铝中存在电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解
.
(4)当有28.0g W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为
14.9
14.9
L.
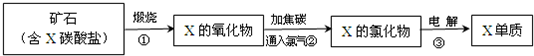
(5)我国陆地上冶炼X的主要流程如图所示,已知当有 lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为
3MgO+3Cl2+2C=3MgCl2+CO2+CO
3MgO+3Cl2+2C=3MgCl2+CO2+CO
.
(6)在新生代的海水中有一种细菌,它们提取海水中W
2+,利用酶为催化剂把W
2+转化为氧化物(可用W
2O
3表示其中W);该反应中的另一种反应物二氧化碳转化为甲醛,请用离子方程式表示上述转化过程(W用具体元素符号表示)
CO
2+4Fe
2++5H
20
HCHO+2Fe
2O
3+8H
+CO
2+4Fe
2++5H
20
HCHO+2Fe
2O
3+8H
+.