
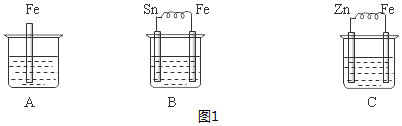
分析 (1)B装置构成原电池,Fe易失电子作负极、Sn作正极,负极Fe失电子发生氧化反应;
(2)C装置构成原电池,Zn易失电子作负极、Fe作正极,正极上氢离子得电子发生还原反应而生成氢气,导致氢离子浓度降低;
(3)作负极的金属>发生化学腐蚀的金属>作正极的金属;
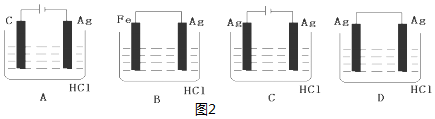
(4)盐酸和银不能自发的进行氧化还原反应,所以不能设计成原电池,只能设计成电解池,失电子的物质作电解池阳极,金属或导电的非金属作电解池阴极,失电子的物质作电解质溶液.
解答 解:(1)B装置构成原电池,Fe易失电子作负极、Sn作正极,负极Fe失电子发生氧化反应,负极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)C装置构成原电池,Zn易失电子作负极、Fe作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为2H++2e-=H2↑,导致氢离子浓度降低,溶液的pH增大,故答案为:增大;
(3)金属腐蚀快慢速率:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为B>A>C,
故答案为:B>A>C;
(4)2HCl+2Ag=2AgCl↓+H2↑不能自发进行,所以必须设计成电解池,该反应中银失电子,所以银作电解池阳极,金属或导电的非金属作电解池阴极,该反应中氯化氢得电子生成氢气,则选取盐酸作电解质溶液,所以C选项符合条件,
故选C.
点评 本题考查原电池原理,正确判断正负极并会书写电极反应式,知道金属被腐蚀快慢速率,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
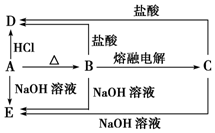 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448 kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6 kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H-O键比H-N键弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaCl、Na2CO3 | C. | NaCl、I2 | D. | NaCl、NaI、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列关于Na2CO3和NaHCO3的说法中不正确的是
A.可用澄清石灰水鉴别这两种物 质
质
B.Na2CO3比NaHCO3更稳定
C.相同条件下0.5 mol/L Na2CO3溶液碱性比NaHCO3 强
D.等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成的二氧化碳质量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com