
| A. | 第一电离能:B>Be>Li | |
| B. | 电负性:F>N>O | |
| C. | Fe2+的最外层电子排布式为:3s23p63d6 | |
| D. | 基态铜原子的价电子排布图: |
分析 A、Be元素最外层为全充满结构,较稳定;
B、非金属性越强电负性越强;
C、Fe的原子序数为26,电子排布为[Ar]3d64s2,所以Fe2+的最外层电子排布式为:3s23p63d6;
D、Cu的原子序数为29,价电子排布为3d104s1.
解答 解:A、Be元素最外层为半充满结构,较稳定,应最大,所以第一电离能:Li<B<Be,故A错误;
B、非金属性越强电负性越强,所以电负性F>O>N,故B错误;
C、Fe的原子序数为26,电子排布为[Ar]3d64s2,所以Fe2+的最外层电子排布式为:3s23p63d6,故C正确;
D、Cu的原子序数为29,价电子排布为3d104s1,基态铜原子的价电子排布图为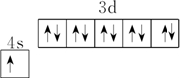 ,故D错误;
,故D错误;
故选C.
点评 本题考查原子核外电子排布,明确原子序数及价电子排布是解答本题的关键,注意电子排布规律及全满、半满为稳定结构,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
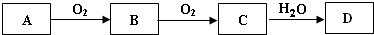
 2SO3.
2SO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
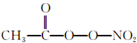 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
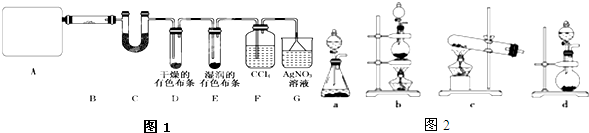
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
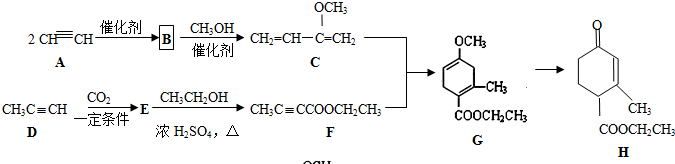
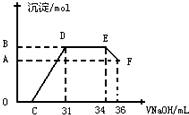
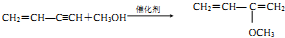 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com