
| A. | 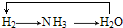 | B. | 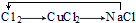 | ||
| C. | 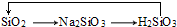 | D. | 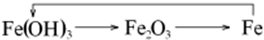 |
分析 A.氢气与氮气反应生成氨气,氨气催化氧化生成水和一氧化氮,电解水生成氢气;
B.氯气与铜反应生成氯化铜,氯化铜与氢氧化钠反应生成氯化钠和氢氧化铜沉淀,电解熔融的氯化钠生成氯气和钠;
C.二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,硅酸分解生成二氧化硅;
D.氢气与氮气反应生成氨气,氨气催化氧化生成水和一氧化氮,电解水生成氢气.
解答 解:A.氢气与氮气反应生成氨气,氨气催化氧化生成水和一氧化氮,电解水生成氢气,所以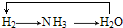 能够实现转化,故A不选;
能够实现转化,故A不选;
B.氯气与铜反应生成氯化铜,氯化铜与氢氧化钠反应生成氯化钠和氢氧化铜沉淀,所以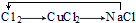 能够实现转化,故B不选;
能够实现转化,故B不选;
C.二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,硅酸分解生成二氧化硅,所以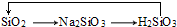 能够实现转化,故C不选;
能够实现转化,故C不选;
D.铁不能一步反应生成氢氧化铁,所以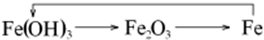 不能够实现转化,故D选;
不能够实现转化,故D选;
故选:D.
点评 本题考查了物质之间的转化,明确相关物质的性质和发生的反应是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
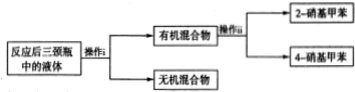
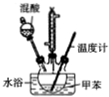 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质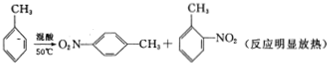
| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
| 4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 研制乙醇汽油技术,能够降低机动车尾气中有害气体的排放 | |
| B. | 联合制碱法生产纯碱时,在饱和食盐水中先通入二氧化碳,再通入氨气 | |
| C. | 接触法制备硫酸的过程中,在吸收塔内是用大量的水吸收三氧化硫 | |
| D. | 工业上通过电解熔融氧化铝制备金属铝时,常常加入冰晶石作助熔剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
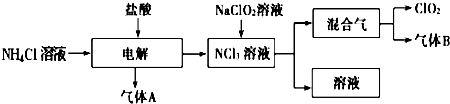
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| B. | 不慎将苯酚沾到皮肤上应立即用酒精清洗 | |
| C. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| D. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
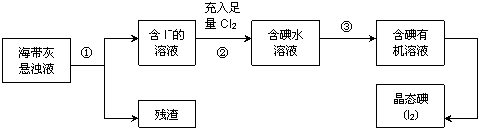
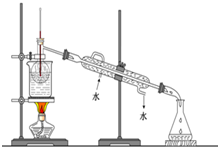
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com