
 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
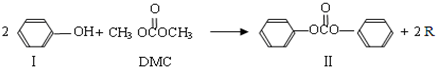
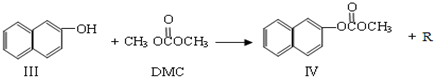
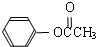 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是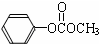 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体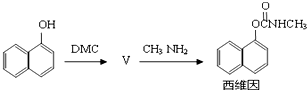
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| HBr |
| 催化剂 |
| 操作a |
| NaOH溶液 |
| △ |
| 操作B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稳定性:PH3>H2S>HCl |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、酸性:HClO4>HBrO4>HIO4 |
| D、非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积:②>③>④>① |
| B、密度:②>③>④>① |
| C、质量:②>③>④>① |
| D、H原子个数:①>③>②>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制乙酸乙酯时,迅速将乙醇注入浓硫酸中 |
| B、在石油蒸馏装置中,将温度计水银球插入液面以下 |
| C、用铂丝蘸取少量KCl溶液置于火焰上灼烧,直接观察火焰颜色,检验K+的存在 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CHO |
| B、CH2=CHCHO |
| C、CH3CH2CH2CHO |
| D、CH2=CHCH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com