
【题目】色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( ) 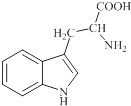
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
【答案】D
【解析】解:A.根据结构简式知,色氨酸的分子式为C11H12N2O2 , 故A正确;
B.色氨酸中含有碳碳双键、氨基、羧基和苯环,具有烯烃、氨基酸和苯的性质,能发生加成反应、氧化反应、缩聚反应、加聚反应、还原反应、酯化反应、中和反应,故B正确;
C.色氨酸中含有羧基和氨基,能和碱、酸反应生成盐,烃基相对分子质量较大,烃基对其溶解度影响较大,所以微溶于水,故C正确;
D.色氨酸分子中含有两个氨基一个羧基,甘氨酸中含有一个羧基和一个氨基,色氨酸自身能形成两种二肽、甘氨酸自身能形成一种二肽,色氨酸与甘氨酸(NH2CH2COOH)能形成三种二肽,所以一共能形成6种二肽,故D错误;
故选D.
【考点精析】通过灵活运用有机物的结构和性质,掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解即可以解答此题.


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸试剂的物质的量浓度为18.4 mol/L
B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( ) 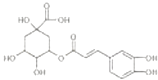
A.绿原酸分子中有4个手性碳原子
B.绿原酸能发生显色反应、取代反应和加成反应
C.每摩尔绿原酸最多与4 mol NaOH反应
D.绿原酸分子中所有碳原子都能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42—、Cl-B.K+、OH-、NO3—、Fe3+
C.Al3+、Cu2+、SO42—、Cl-D.Na+、Ca2+、Cl-、CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: ![]()
(1)上述转化中属于取代反应的是 , D的核磁共振氢谱有组峰.
(2)![]() 的名称 , C中官能团的名称为 , DMP的分子式为 .
的名称 , C中官能团的名称为 , DMP的分子式为 .
(3)A→B的化学方程式为 .
(4)E是D的芳香族同分异构体,E具有如下特征:①遇FeCl3溶液显紫色;②能发生银镜反应;③苯环上有三个取代基,则符合条件的E最多有种,写出其中任意两种物质的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液
B.铁片置于硫酸铜溶液中
C.铁在氧气中燃烧
D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣l
C(s)+O2(g)=CO2(g) △H=﹣393.5kJmol﹣l
2C(s)+O 2(g)=2CO(g) △H=﹣221kJmol﹣l
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式__________________________________________________________。
,请写出此反应的热化学方程式__________________________________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g)。若在恒容绝热的密闭容器中充入一定量 N2O5进行该反应,下列选项能判断该反应达到平衡状态的是_______。
4NO2(g)+O2(g)。若在恒容绝热的密闭容器中充入一定量 N2O5进行该反应,下列选项能判断该反应达到平衡状态的是_______。
A.v 正(N2O5)=2v 逆(NO2) B.容器内NO2浓度是O2浓度的4倍
C.平衡常数K不再随时间而变化 D.混合气体的密度保持不变
E.混合气体的压强不随时间而变化
(3)工业上也可以利用I2O5消除CO的污染。已知:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的4L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间变化的曲线如下图。回答下列问题:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的4L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间变化的曲线如下图。回答下列问题:

①下列说法正确的是______________
A.d点时,增大体系压强,CO的转化率变大
B.T2时,0~2.0min内的反应速率v(CO)=0.6molL﹣lmin﹣l
C.b点时,向平衡体系中再加入I2O5(s),平衡向正反应方向移动
D.c点时体系中混合气体的压强在T2温度下更大
②5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)△H=_________0(填“>”、“=“、“<“),判断理由是______________________________________________。
5CO2(g)+I2(s)△H=_________0(填“>”、“=“、“<“),判断理由是______________________________________________。
(4)N2O4与 NO2之间存在反应:N2O4(g)![]() 2NO2(g)△H=QkJmol﹣l.将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如下图所示.如图 中 a 点对应温度下,已知 N2O4的起始压强 p0为 200kPa,该温度下反应的平衡常数的计算表达式Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2NO2(g)△H=QkJmol﹣l.将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如下图所示.如图 中 a 点对应温度下,已知 N2O4的起始压强 p0为 200kPa,该温度下反应的平衡常数的计算表达式Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com