
【题目】熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- =34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
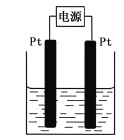
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水
①写出反应的离子方程式 。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
【答案】(1)2C4H10+13O2=8CO2+10H2O;
(2)O2+2CO2 +4e-=2CO32-
(3)CO2;负极反应产物
(4)①2Cl-+2H2O![]() Cl2↑+H2↑+2OH- ;②5Cl2+I2+6H2O=10HCl+2HIO3;③560
Cl2↑+H2↑+2OH- ;②5Cl2+I2+6H2O=10HCl+2HIO3;③560
【解析】
试题分析:(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,故答案为:2C4H10+13O2=8CO2+10H2O;
(2)燃料电池中负极上是燃料失电子的氧化反应子,电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O;故答案为:2C4H10+26CO32--52e-=34CO2+10H2O;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知必需通入CO2,二氧化碳可以来自负极反应产物,故答案为:CO2;负极反应产物;
(4))①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=
Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=![]() ×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=
×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=![]() ×22.4L/mol=560mL,故答案为:560。
×22.4L/mol=560mL,故答案为:560。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用 0.50 mol/L NaOH 溶液和 0.50 mol/L H2SO4 溶液进行中和热的测定。
Ⅰ.配制 0.50 mol/L NaOH 溶液
(1)实验中大约要使用 245 mL NaOH 溶液,则至少需要称量 NaOH 固体 g。
(2)从表中选择称量 NaOH 固体所需要的仪器 (填序号)。

Ⅱ.测定中和热的实验装置如图所示。

(3)写出稀硫酸和稀 NaOH 溶液反应表示中和热的热化学方程式 (中和热为 57.3 kJ/mol)。

①温度差的平均值为__________。
②使硫酸与 NaOH 溶液混合均匀的正确操作是 (填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
③近似认为 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸的密度都是 1g/cm3,中和后生成溶液的比热容 c = 4.18 J/(g·℃),则中和热 Δ H= ________(结果保留小数点后一位)。
④上述实验结果与 57.3 kJ/mol 有偏差,产生偏差的原因可能是__________(填字母)。
A.实验装置保温、隔热效果差
B.量取 NaOH 溶液的体积时仰视读数
C.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
D.用温度计测定 NaOH 溶液起始温度后直接测量 H2SO4 溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
B、已知甲烷的标准燃烧热为ΔH=-890.3 kJ/mol 则甲烷燃烧热的热化学方程式为:CH4 (g) + 2O2 (g) = CO2(g) + 2H2O(g) ΔH=-890.3 kJ/mol
C、一定条件下,0.5 mol N2 和1.5 mol H2在密闭容器中充分反应生成NH3,放热19.3 kJ,其热化学方程式为:N2 (g)+ H2 (g)![]() 2NH3(g) ΔH =-38.6 kJ/mol
2NH3(g) ΔH =-38.6 kJ/mol
D、2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)ΔH=-57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
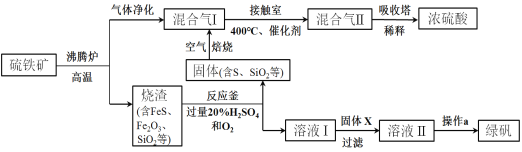
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是 。
(4)操作a的主要步骤是:加热浓缩、 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或 ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+![]() +
+![]() ===
===![]() Fe2++
Fe2++![]() SO42-+
SO42-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应会导致溶液导电性减弱最明显的是( )
A. Na2SO4溶液加入BaCl2固体
B. Ba(OH)2溶液中加入CuSO4(少量)固体
C. NaOH溶液通入HCl
D. H2O中加入NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:
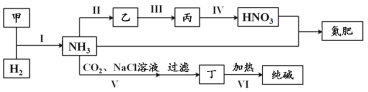
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”“=”“<”)。
(2)减压使容器体积增大时,A的质量分数 (填“增大”“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率 。
(4)若升高温度,则平衡时B、C的浓度之比将 。
(5)若加入催化剂,平衡时气体混合物的总物质的量 。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ,而维持容器内压强不变,充入氖气时,再次建立平衡时与原平衡相比,气体混合物颜色 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com