
��ͼ��ʾ��

��֪��
�ټס��ҡ���������Ϊǰ������Ԫ�صĵ��ʡ�?
����һ�������¼�����ͼ��붡�������ʵ���֮��1��3��Ӧ���ֱ�����X��Y���ڲ�����Ԫ�ؼ׳ʸ��ۡ�?
����һ������������������붡�������ʵ���֮��1��2��Ӧ���ֱ�����Z��W���ڲ�����Ԫ���ҳʸ��ۡ�?
����գ�?
��1������ ������ ��
��2���������Ӧ����X�Ļ�ѧ����ʽ�� ��
��3�����붡��Ӧ����W�Ļ�ѧ����ʽ�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
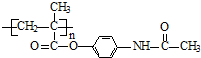
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijѧ���������ʼ�Ļ��䣬��Ƴ�һ��ƽ��ħ������ͼ��ʾ��
ijѧ���������ʼ�Ļ��䣬��Ƴ�һ��ƽ��ħ������ͼ��ʾ��| ��A�����ʣ� | B��Һ | C���� | D���� | G��Һ | |
| ��ɫ | ����ɫ | ��ɫ | ���ɫ | ����ɫ | dz��ɫ |
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

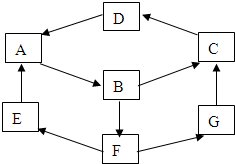
 ��
��
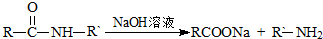
 ��ת��Ϊ1mol A��1mol B����A��FeCl3��Һ��������ɫ��д��A��ϡ��Һ�����Ũ��ˮ������Ӧ�Ļ�ѧ����ʽ
��ת��Ϊ1mol A��1mol B����A��FeCl3��Һ��������ɫ��д��A��ϡ��Һ�����Ũ��ˮ������Ӧ�Ļ�ѧ����ʽ

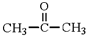
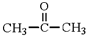




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2SO2��g��+O2��g��?2SO3��g������Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ġ�H=-99kJ/mol��
2SO2��g��+O2��g��?2SO3��g������Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ġ�H=-99kJ/mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
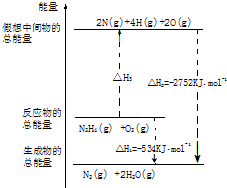 �����£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�ã�
�����£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����ͬ���ܱ������о�����1mol X��1mol Y���ֱ���300���500�濪ʼ������Ӧ��X��g��+Y��g��?3Z��g����Z�ĺ�����Z%����ʱ��t�ı仯��ͼ��ʾ����֪��t3ʱ�̸ı�����bijһʵ�������������ж���ȷ���ǣ�������
�����ͬ���ܱ������о�����1mol X��1mol Y���ֱ���300���500�濪ʼ������Ӧ��X��g��+Y��g��?3Z��g����Z�ĺ�����Z%����ʱ��t�ı仯��ͼ��ʾ����֪��t3ʱ�̸ı�����bijһʵ�������������ж���ȷ���ǣ�������| A������a��500��ʱ��ͼ�� | ||
B����0��t1ʱ�̣���Ӧ��X��g����
| ||
C��t2ʱ��������Z����
| ||
| D��t3ʱ�̸ı�����������ǽ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com