
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(2)△G=△H-T△S<0时,反应自发进行;
(3)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
一般在过渡元素中需找合适的催化剂;
催化剂不影响化学平衡移动,说明催化剂同等程度改变正逆反应速率;
(4)原电池正极发生还原反应,二氧化碳与氧气在正极通入,氧气获得电子生成碳酸根离子;
(5)由题目信息可知,二氧化碳与硫化氢反应得到(C6H10O3)n和淡黄色固体S,由C、O比例关系可知应有水生成,配平书写方程式.
解答 解:(1)已知:①.CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
②.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
根据盖斯定律,②-①可得:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1,
故答案为:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1;
(2)反应的△H=+247.4kJ•mol-1,△S=0.257kJ•mol-1•K-1,△G=△H-T△S<0时,反应自发进行,故247.4kJ•mol-1-T×0.257kJ•mol-1•K-1<0,解得T>926.6K,
故答案为:926.6K;
(3)反应CH4(g)+CO2(g)?2CO(g)+2H2(g)的平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;一般在过渡元素中需找合适的催化剂;催化剂不影响化学平衡移动,说明催化剂同等程度改变正反应速率、逆反应速率,
故答案为:$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;过渡;催化剂不影响化学平衡移动,说明催化剂同等程度改变正反应速率、逆反应速率;
(4)原电池正极发生还原反应,二氧化碳与氧气在正极通入,氧气获得电子生成碳酸根离子,电极反应式为:2CO2+O2+4e-=2CO32-,
故答案为:2CO2+O2+4e-=2CO32-;
(5)由题目信息可知,二氧化碳与硫化氢反应得到(C6H10O3)n和淡黄色固体S,由C、O比例关系可知应有水生成,该反应方程式为:6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O,
故答案为:6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O.
点评 本题属于拼合型题目,涉及热化学方程式书写、反应自发性问题、平衡常数、催化剂对反应速率与化学平衡乙烯、原电池、化学方程式书写等,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
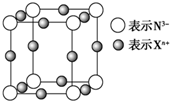
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏、石油的分馏都只发生了物理变化 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成了CO2和H2O | |
| C. | 甲烷和苯都能发生取代反应 | |
| D. | 乙醇和乙酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2气体通入Na2SiO3中可生成NaHCO3; 足量的CO2气体通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、⑤ClCH=CHCl⑥
、⑤ClCH=CHCl⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨
、⑨

 (或
(或 )
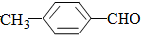
)

 溶解性由大到小的顺序
溶解性由大到小的顺序 >
> >
>
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com